cladosporium spp что это такое
Аллергическая реакция часто возникает по неизвестной на первый взгляд причине. Мало кто задумывается, что причиной такой напасти является плесневый грибок. Кладоспориум – что это за плесень, какие симптомы она вызывает у детей и взрослых, как ее лечить? Этот грибок является плесенью, который живет в почве, на растениях или в других местах с подходящими условиями. При попадании в органы дыхания человека, он может спровоцировать аллергию.
Грибок Cladosporium herbarum
Места обитания
Главным условием выживания плесневого грибка Кладоспориум является повышенная влажность. Привычным местом обитания для него является почва. При недостаточной выработке полифенола микроорганизм также может паразитировать на плодах или листьях растений. Идеальное условие для роста и размножения грибка является теплицы или парники. Грибок находят в таких местах:
В жилом помещении грибок Кладоспориум отлично себя чувствует в ванной комнате, туалете. Постоянная влажность воздуха и тепло приводит к образованию очагов развития. Их легко определить по оливковому налету на поверхности. Обратите внимание на углы, занавеску в ванне, стенки душевой кабины, поверхность труб, вытяжку. «Сожительство» с грибком может быть чревато аллергической реакцией и другими проблемами со здоровьем, поэтому от незваного гостя необходимо избавляться.
Размножение
Главной опасностью плесневого грибка Кладоспориум является его способность распространяться по воздуху. Споры грибов и его фрагменты легко проникают в помещения, быстро обживаются в вышеперечисленных местах. Для активного роста грибка нужна хорошая влажность. Идеальным местом является почва и листва, гниющая осенью. Признаки заражения грибком хорошо видны на листьях, они приобретают светло-коричневый пигмент в виде пятен на поверхности растений.
Аллергия на плесень Cladosporium
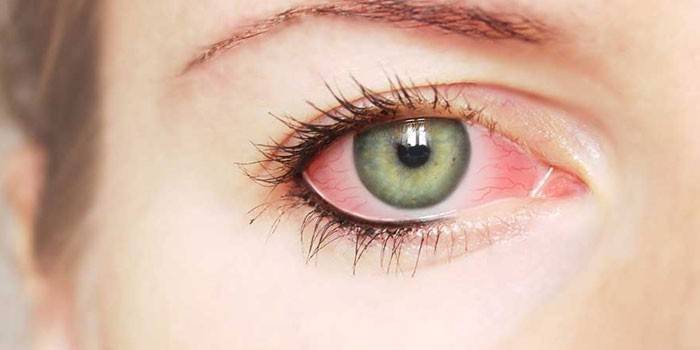
Кладоспориум – это один из самых распространенных видов плесневого грибка, на который может развиться аллергия у детей и взрослых. Он легко проникает в дыхательные пути человека, вызывая приступы кашля, слезоточивость и другие неприятности. Плесень может быть как наружным, так и внутренним источником заражения. Если вы заметили у себя или своих близких симптомы заболевания при близком контакте грибковой плесени, нужно записаться на прием к врачу. Не занимайтесь самолечением, это может быть опасно.
Симптомы
Кладоспориоз, который проявляется при попадании микроскопических частичек грибка в органы дыхания, может стать причиной бронхиальной астмы и легочной пневмонии. Он определяется по таким симптомам:
Диагностика
Основной целью диагностики является выявление увеличенной чувствительности организма человека к возбудителям аллергии и определение степени чувствительности дыхательной системы к воздействию на каждый аллерген. Этими задачами занимаются аллергологи и микологи. Существует три основных метода диагностики:
Название метода диагностирования
Описание метода диагностирования
Анализ крови на антитела и иммуноглобулины класса Е
При помощи этого анализа можно выявить наличие аллергии у человека, когда нужно отличить симптомы аллергии от, например, хронического ринита.
Помогает выявить паразитов.
Определяет сопротивляемость организма, т.е. иммунный статус.
Для этого анализа берется кожная проба. Анализ представляет собой тест оценки состояния сенсибилизации к определенному аллергену.
Исследование IgG антител
Это анализ крови на антитела, который проводится для уточнения диагноза при определенных инфекциях или для определения общего состояния иммунной системы.
Лечение грибковой аллергии
Кладоспориоз протекает нестабильно, заболевание может активно себя проявлять или находится в состоянии покоя. Больному необходимо позаботиться о профилактических мерах. Для этого необходимо регулярно убирать жилое помещение с применением антисептических и антимикозных средств, не допускать влажности. Особе внимание уделяйте ванной комнате с туалетом.
Что касается лечения грибковой аллергии, то она проводится строго под наблюдением врача. Больному после подтверждения диагноза будут назначены противогрибковые и антигистаминные препараты, средства, убирающие симптомы заболевания, например, капли или спреи для снятия воспаления со слизистой оболочки. Пациент должен понимать, что без уничтожения грибкового аллергена, лечение не принесет хорошего и быстрого результата.
Cladosporium spp что это такое
Определение в крови специфических антител, иммуноглобулинов класса E, появляющихся при наличии аллергической реакции к плесневым грибам Cladosporium herbarum.
Аллергенспецифический IgE к плесневым грибам Cladosporium herbarum.
Иммунофлюоресценция на твердой фазе (ImmunoCAP).
кЕдА/л (килоединица аллергена на литр).
Какой биоматериал можно использовать для исследования?
Венозную, капиллярную кровь.
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Cladosporium herbarum обнаруживается преимущественно вне помещений и обитает на растениях. Концентрация спор данного гриба в воздухе в наших широтах увеличивается в весенне-летне-осенний период и уменьшается зимой.
Целью данного исследования является определение специфических IgE к аллергену Cladosporium herbarum методом ImmunoCAP. Аллергодиагностика технологией ImmunoCAP характеризуется высокой точностью и специфичностью, что достигается обнаружением в очень малом количестве крови пациента даже низких концентраций IgE-антител. Исследование основано на иммунофлюоресцентном методе, что позволяет увеличить чувствительность в несколько раз по сравнению с другими диагностическими методами. Во всем мире до 80% определений специфических иммуноглобулинов IgE выполняется данным методом. ВОЗ и Всемирная организация аллергологов признают диагностику с использованием ImmunoCAP как «золотой стандарт», так как эта методика доказала свою точность и стабильность результатов в независимых исследованиях.
Для чего используется это исследование?
Когда назначается исследование?
Что означают результаты?
Причины повышенного результата:
Причины отрицательного результата:
+ определение специфических иммуноглобулинов класса E к прочим аллергенам
Кто назначает исследование?
Аллерголог, гастроэнтеролог, дерматолог, педиатр, терапевт, врач общей практики.
Cladosporium spp что это такое
Другими японскими авторами было установлено, что использование кондиционеров уменьшает количество спор грибов в помещении на две трети [15].
Даже используя устройства количественного учета, между практически идентично полученными пробами возможны огромные различия (до 1000 раз). Таким образом, исследование единичных проб воздуха представляется недостаточно достоверным. Кроме того, исследование необходимо проводить без применения, так как «агрессивных» методов забора материала в помещении (например, с использованием пылесоса), когда моно получить более высокие количественные показатели, чем это имеет место фактически. Хантер и соавт. (1988) [7] обнаружили, что механическое воздействие непосредственно на места роста и чистка ковров пылесосом (методы, часто использованные в обзорах) вызывают значительное временное увеличения числа спор в воздухе. После механического воздействия на колонии роста плесневых грибов (например, просто протирая их рукой) наблюдали значительное увеличение числа спор плесневых грибов (в 33 раза). На реальное количество спор в воздухе также влияют и другие факторы: наличие ковров, домашних животных, увлажнителей воздуха и кондиционеров. Наконец, важную роль при попытке количественного определения некоторых видов грибов может играть размер самих частиц (клеток): например, быстрое оседание больших спор грибов рода Ulocladium вероятно объясняет недостаточную представленность их в пробах воздуха.
Впрочем, существует мнение, что вообще нет необходимости проводить микологическое исследование помещения, если имеется видимый рост грибов, поскольку в любом случае показано их удаление (чистка, устранение загрязненного материала) и контроль за влажностью воздуха.
Грибы в помещениях и заболевания человека.
Грибы в целом, и плесени, в частности, могут вызывать заболевания человека тремя путями:
В этом обзоре мы разбираем только вторую и третью формы воздействия грибов на организм, поскольку инфекции, вызываемые грибами, обычно рассматриваются как отдельные нозологические формы.
Большинство исследований, в которых описано влияние на здоровье человека влажности и плесени внутри помещений, базируется на субъективных и ретроспективных (анкетных) опросах. Лишь немногие исследования включали результаты физикального обследования или диагностических тестов. В таком подходе заключены очевидные потенциальные проблемы. Чтобы исследовать достоверность описываемых самими больными симптомов, некоторые исследователи сравнили сообщения родителей о кашле у детей с ночной регистрацией кашля посредством записи на магнитофон [20]. В результате показано чрезвычайно низкое соответствие между этими двумя измерениями. Кроме того, родители-курильщики обычно занижали сведения о кашле у их детей. Та же самая группа исследователей проверила объективность ответов на вопросы, в которых указывалось на присутствие плесеней внутри помещений в сравнении с объективным измерением наличия плесеней (например, измерение уровня эргостерола в воздухе) [21]; обнаружено, что если имелись сообщения о характерном плесневом запахе или протечках, то плесеней обнаруживали больше, и что когда указывали на наличие «пятен плесени», было найдено пенициллов и аспергиллов вдвое больше. Однако информация о присутствии плесени или протечек была недостаточно объективной: так, например, пациенты-аллергики, даже несмотря на низкие уровни жизнеспособных грибов в пыли, чаще сообщали о наличии видимых проявлений грибкового роста, в то время как курильщики отмечали видимые плесневые поражения реже. В целом, погрешность была довольно высокой, и явно имел место выраженный субъективный фактор, что заставило авторов сделать заключение, что все-таки следует обязательно проводить объективные измерения, а не анкетные опросы.
И в другом исследовании взаимосвязи между видимым ростом плесени в помещениях и симптомами авторы попробовали подтвердить результаты объективными тестами [22]. Используя ту же самую группу, как и в их предыдущей работе (n = 403 дома), они сравнили сообщения о респираторных симптомах с объективными измерениями, включая наличие в воздухе эргостерола, пыли, определяя число жизнеспособных спор грибов и проведя ночную регистрацию кашля. Несмотря на относительное увеличение на 25-50% частоты симптомов в случаях, когда имелись сообщения о присутствии плесени в доме, ни симптомы, ни записи кашля не были связаны с объективным наличием грибов. Знаменательно, что авторы этой работы, являясь фактическими сторонниками связи заболевания с наличием плесени в доме, делают заключение о том, что субъективные жалобы являются неадекватными «измерителями» патологии, притом, возможно, даже очень серьезной. Ретроспективные субъективные анкетные опросы, в лучшем случае, позволяют лишь сделать предположение о наличии неблагоприятного воздействия. Подобные отрицательные результаты были получены при исследовании субъективных неврологических жалоб при определении «синдрома больного здания»[23].
Такие результаты могут объяснить довольно неубедительные данные в более ранних исследованиях. Например, некоторые авторы заявляли о связи между детской астмой и влажными заплесневелыми помещениями [24]. В то время как в ретроспективных анкетных опросах сообщалось о большем количестве хрипов, кашле и симптомах простуды у детей, проживающих в поврежденных сыростью зданиях, частота выявленного бронхоспазма в этой и контрольной группах никак не различалась. Таким образом, несмотря на сделанные в работе выводы о том, что существовала причинная связь между плесенью в доме и хрипами, никаких объективных свидетельств этого получено не было. В других исследованиях, в которых утверждалось, что влажность и плесень связаны с респираторными инфекциями, кашлем и хрипами, также нет различий в частоте астмы между группами [25].
Аллергические реакции от воздействия плесневых грибов на легочную ткань хорошо описаны в очень широком диапазоне: от воспаления верхних дыхательных путей (риниты) с сопутствующим конъюнктивитом до тяжелой бронхиальной астмы, аллергического бронхолегочного аспергиллеза и экзогенного аллергического альвеолита (ЭАА).
Существует вероятная связь клинических проявлений с размерами аллергоактивных частиц, поскольку аллергические реакции возникают непосредственно в местах депозиции аллергена. Большинство ингалируемых частиц >10 мкм (такой размер имеет большинство зерен пыльцы и самые большие споры грибов) оседает в носоглотке и ассоциируется с симптомами в носу или глазах, что наиболее четко проявляется при поллинозе. Напротив, частицы
Несмотря на заявления о том, что загрязнение зданий плесневыми грибами сопряжено с усилением симптомов бронхиальной астмы, имеется очень мало объективных данных, подтверждающих это положение. Например, в одном из немногих исследований, в котором использовали спирометрию с провокационным метахолиновым тестом, не установлено снижения дыхательной функции [34]. Другие авторы сообщали о снижении диффузионной способности легких у лиц с респираторными симптомами, работающих в так называемых «проблемных» зданиях, но никаких изменений в других функциональных дыхательных тестах выявлено не было. В результате так и осталось неясным, были ли эти симптомы связаны с пребыванием в здании или же были вызваны другими причинами [35].
В то время как связь содержащегося в воздухе 1-3-ß-D-глюкана со случаями воспаления дыхательных путей и бронхиальной астмой довольно широко обсуждается, для такого утверждения имеется очень мало доказательств.
Клинические токсикологические синдромы, связанные с попаданием с пищей больших количеств микотоксинов, хорошо описаны у животных в широком диапазоне: от внезапной смерти до замедления роста и снижения репродуктивной функции. Эффекты, оказываемые на людей, значительно менее хорошо определены (таблица 2).
Заболевания человека и животных, связанные с микотоксинами (по Кюхну и Гханноуму (2003) [16] с изменениями).
Cladosporium spp что это такое
Современный взгляд на проблему микогенной аллергии
Автор статьи: Козлова Я.И., врач аллерголог-иммунолог, доцент кафедры клинической микологии, аллергологии и иммунологии ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава РФ, кандидат медицинских наук.
Выделяют две основные группы грибов:
Главные таксономические группы (классы) грибов: Ascomycetes, Basidiomycetes, Zygomycetes, Oomycetes и Deuteromycetes. Для практического использования более полезна экологическая классификация главных аллергенных грибов (таблица,1). Она объединяет группы микромицетов, которые спороносят при одинаковых условиях (например, увеличение концентрации спор в один и тот же сезон).
Таблица 1. Экологическая классификация главных аллергенных грибов
Ascomycetes:
Alternaria, Cladosporium, Epicoccum, Curvularia
На поверхности листьев, ванная комната
Увеличение концентрации при сухой ветреной погоде
Basidiomycetes:
Pleurotus, Ganoderma, Calvatia, Coprinus
На гниющих деревьях, в темных местах и парках
Преимущественно «outdoor». Возможна высокая концентрация в воздухе, не зависящая от внешних условий.
Deteromycetes:
Почва, мусор, сырые листья, склады, подвалы
Преимущественно «indoor». Увеличение концентрации при высокой влажности, сырости
Аллергенами грибов могут быть следующие их вещества:
Галактозамины, полисахариды входят в состав клеточной стенки грибов и служат распространенными аллергенами. Хотя чистые полисахариды являются Т-независимыми антигенами и индуцируют ответ В-лимфоцитов, примесь пептидов и липидов обеспечивает развитие всех видов иммунного ответа.
Наиболее важные аэроаллергены – Alternaria, Asperillus, Cladosporium, Penicillium.
Alternaria alternate принадлежит к Ascomycetes и является одним из важных аллергенных грибов. Выявлена связь между сенсибилизацией к Alternaria и угрожающей жизни астмой. Споры Alternaria обнаруживают в воздухе круглогодично с пиковыми уровнями в августе и осенью. Был выделен главный аллерген Alt a 1.
Cladosporium herbarum принадлежит к Deuteromycetes, обнаруживают преимущественно вне помещений и в отличие от Aspergillus, в холодном климате, например в Скандинавии. Концентрация спор Cladosporium достигает пика в весенне-осенний период и уменьшается с первыми заморозками. Было выделено три главных аллергена: Cla h 1, Cla h 2 и Cla h 4.Cladosporium содержит энолазу – главный аллерген в большинстве грибов.
Penicillium citrinum принадлежит к Deuteromycetes и является важным внутренним аллергеном. Как и Aspergillus, относится к «складским грибам» и присутствует в хранилищах зерна, фруктов и овощей. Смеси белых мягких сыров («Камамбер», «Бри», «Гаргонзола» и «Рокфор») содержат плесени, принадлежащие роду Penicillium. По данным современных исследований пациенты с аллергией на вдыхание спор плесени обычно не имеют аллергию на плесневой сыр.
Таблица 2. Характеристика главных грибковых аллергенов
Молекулярная масса, кДа
70 кДа гликопротеид
Белок теплового шока
Гомолог фибриногенсвязывающего белка C.albicans
Пероксисомный мембранный протеин
Гомолог грибкового рибофлавина
Гомолог растительной и бактериальной эндо-β-1,3-1,4-глюконазы
Белок теплового шока
Гомолог сериновой протеазы
Вакуольная сериновая протеаза
1,3 –рибосомный белок
Рибосомный белок Р2
Вакуольная сериновая протеаза
Рибосомный белок Р1
Пероксисомный мембранный белок
Белок теплового шока
Фактор элонгации 1β
Микогенная аллергия
Чтобы подчеркнуть роль микромицетов в развитии аллергических заболевании, в 1983 году в Гамбурге на совещании экспертов ВОЗ был предложен термин «микоаллергозы». Однако еще в 1726 году John Floyer описал развитие приступов удушья у больных БА после посещения ими винных подвалов. В 1873 году Blackley выявил роль грибов Chaetomium spp. и Penicillium spp. в провоцировании приступов БА.
Диагностика микогенной аллергии
Cбор анамнестических данных – первый и очень важный этап выявления микогенной аллергии. Он подразумевает сбор не только сведений, полученных со слов пациента, но и анализ медицинской документации: данных амбулаторной карты больного, выписок из стационаров и т.д. У больного необходимо уточнить первые симптомы заболевания и время их появления, динамика развития, возможный контакт с плесневыми грибами дома или на работе, наличие аллергических реакций, наследственность по атопии, предшествующая терапия и ее эффективность.
На сегодняшний день врачи располагают следующими средствами специфической диагностики гиперчувствительности к грибковым аллергенам: кожные тесты и определение специфических IgE-антител (sIgE). Ингаляционный провокационный тест с антигенами Aspergillus spp. не рекомендован в связи с возможностью развития фатального бронхоспазма. К недостаткам кожного тестирования относят риск развития побочных реакций организма на дополнительную антигенную нагрузку, возможность возникновения ложноположительных и ложноотрицательных результатов. Кроме того, в настоящее время в России нет ни отечественных, ни зарубежных грибковых аллергенов для in vivo диагностики, представленных в Реестре в Министерстве Здравоохранения России.
Основными преимуществами методов специфической аллергодиагностики in vitro являются безопасность для больного и высокая информативность. Определение специфических IgE in vitro является одним из самых распространенных методов диагностики микогенной аллергии немедленного типа. Основными методами исследований являются иммуноферментный (ИФА), иммунохемилюминисцентный (ИХЛА), иммунофлюоресцентный (ИФЛА) анализы. В настоящее время большинство лабораторий используют одну из трех технологий. Однако наибольшее распространение получил иммуноферментный метод из-за его высокой специфичности и экономической доступности.
Компания Алкор Био разработала широкий спектр грибковых аллергенов. Биотинилированная форма аллергенов обеспечивает высокую чувствительность и специфичность иммуноферметного анализа. Основываясь на нашем опыте, можно с уверенностью утверждать, что тест-системы «АллергоИФА специфические IgE» производства Алкор Био являются оптимальным инструментом для подтверждения микогенной сенсибилизации у разных категорий больных.
Кроме того, в настоящее время идет поиск новых тестов, которые позволят выявить патогенетические механизмы аллергии, диагностировать и дифференцировать псевдоаллергические реакции. Одним из наиболее перспективных направлений аллергодиагностики in vitro, в том числе и для выявления микогенной аллергии, является тест активации базофилов специфическими аллергенами с помощью проточной цитометрии.
Тяжелая бронхиальная астма с микогенной сенсибилизацией (ТБАМС)
Предполагают, что тяжелое течение бронхиальной астмы отмечают у 10% больных, а сенсибилизацию к грибам выявляют у 33% таких пациентов. Таким образом, по данным экспертов LIFE (Leading International Fungal Education) расчетное количество больных тяжелой бронхиальной астмой с микогенной сенсибилизацией составляет 6,5 миллионов человек в мире и 231 000 человек в Российской Федерации. Влияние региональных и этнических факторов на распространенность тяжелой бронхиальной астмы в настоящее время не определено.
С тяжелой, жизненно-угрожающей бронхиальной астмой ученые связывают гиперчувствительность к грибам Alternaria spp. и Aspergillus spp. Для детей, сенсибилизированных к Alternaria spp. характерно развитие персистирующей астмы в зрелом возрасте. Однако, ассоциированная сAspergillus fumigatus бронхиальная астма не ограничивается тяжелым течением заболевания. Положительные кожные тесты и/или специфические IgE кAspergillus spp. часто выявляют у больных легкой или среднетяжелой контролируемой бронхиальной астмой.
Аллергический бронхолегочный аспергиллез (АБЛА)
Давно известно, что сенсибилизация к Aspergillus spp. – важный патогенетический этап в развитии такого тяжелого хронического заболевания легких, как АБЛА. Наиболее часто АБЛА осложняет течение бронхиальной астмы и муковисцидоза. Для больных из этих групп характерны нарушения защитных механизмов слизистых оболочек дыхательных путей, в том числе дефекты мукоцилиарного клиренса и функции эпителиальных клеток. Все это облегчает колонизацию дыхательных путей грибковыми спорами.
АБЛА был впервые описан K. Hinson и соавторами в 1952 году. По оценкам экспертов количество больных АБЛА в мире достигает около четырех миллионов человек, а в Российской Федерации – 175 тысяч. Распространенность АБЛА может варьировать в зависимости от этнической принадлежности и концентрации грибковых спор в воздухе. Известно, что многие исследователи связывают обострения АБЛА с воздействием окружающей среды. У больных АБЛА, как правило, отмечают плохо контролируемую бронхиальную астму, хрипы, кровохарканье и продуктивный кашель. Также характерно небольшое повышение температуры тела, потеря веса, недомогание, усталость. У 31-69% больных наблюдают отделение мокроты, содержащей коричневато-черные включения. При физикальном осмотре может быть выявлено осложнение АБЛА – легочная гипертензия. Кроме того, некоторые пациенты, которые получают базовую противоастматическую терапию, не имеют характерных симптомов, и АБЛА не может быть установлен при рутинном обследовании.
Учитывая особенности клинической картины, больные АБЛА обращаются за медицинской помощью к врачам разных специальностей – терапевтам, пульмонологам, аллергологам-иммунологам и др. Но, к сожалению, врачи недостаточно информированы о диагностике и лечении этого заболевания. Во многих странах, в том числе и в России, АБЛА часто не распознают вовремя. В развивающихся странах в 30% случаев устанавливают неправильный диагноз туберкулеза легких. Результаты исследований свидетельствуют, что период между появлением первых симптомов и постановкой диагноза АБЛА может составлять до 10 лет.
Международное общество микологии человека и животных (ISHAM) сформировало рабочую группу «АБЛА у больных бронхиальной астмой» для обобщения результатов современных исследований и составления руководств по диагностике и лечению этого заболевания. Предложенные новые диагностические критерии представлены в таблице 3. Они помогут практикующим врачам своевременно выявить АБЛА, предупредить прогрессирование заболевания и начать терапию.
Таблица 3. Новые диагностические критерии аллергического бронхолегочного аспергиллеза у больных бронхиальной астмой (R. Agarwal et al., 2013)
Факторы риска
Обязательные критерии
(оба должны присутствовать)
Дополнительные критерии
(должны присутствовать два из трех)
* Если пациент отвечает всем другим критериям, то уровень общего
IgE может быть менее 1000 МЕ/мл
**Характерные для АБЛА рентгенологические признаки могут быть временные (летучие инфильтраты) и постоянные (кольцевидные и параллельные тени, бронхоэктазы, плевролегочный фиброз)
Целями терапии АБЛА являются достижение контроля над астмой, профилактика и лечение обострений, предупреждение развития бронхоэктазов и хронического аспергиллеза легких. В качестве противовоспалительной терапии используют системные глюкокортикостероиды, а для уменьшения грибковой нагрузки в дыхательных путях – антимикотические препараты.
Аллергический микотический риносинусит (АМРС)
По данным современных авторов данной патологией страдает от 5 до 10% больных хроническим риносинуситом. Предполагают, что заболеваемость АМРС зависит от географического расположения региона. Наибольшую частоту АМРС выявляют в умеренных широтах, где относительно высокая влажность атмосферного воздуха. Ранее считали, что основными возбудителями АМРС, так же как и аллергического бронхолегочного аспергиллеза (АБЛА) являются Aspergillus spp. На современном этапе ведущую роль исследователи отводят феогифомицетам, в частности Bipolaris spp. Предполагают, что АМРС и АБЛА имеют сходные механизмы патогенеза. А именно развитие I и III типов реакций гиперчувствительности по Gell и Cumbs в ответ на ингаляционные грибковые антигены.
Из лабораторных признаков АМРС основными являются увеличение количества эозинофилов в периферической крови, повышение уровня общего IgE, выявление специфических IgE и IgG к грибковым антигенам в сыворотке крови. Уровень общего IgE при АМРС обычно высокий, и составляет более 1000 ЕД/мл. При проведении кожного тестирования для АМРС характерна положительная проба с Bipolaris spp, Aspergillus spp и другими грибковыми аллергенами.
Прогноз заболевания серьезный. Нераспознанный АМРС может вызывать значительные повреждения костной ткани, приводя к изменениям лицевого скелета. Присоединение бактериальной инфекции может способствовать развитию внутричерепных и орбитальных осложнений. Лечение состоит из комбинации хирургического вмешательства с оральными кортикостероидами. Антимикотические препараты в терапии АМРС не используются, хотя эта область требует дальнейшего изучения.
Лечение микогенной аллергии:

Заключение:
Роль микромицетов в развитии различных заболеваний человека более значима, чем принято считать. Гетерогенность аллергенов грибов – причина смешанных вариантов аллергических реакций и разнообразия клинических форм: от кожных до респираторных заболеваний. Таким образом, диагностика микогенной аллергии является актуальной задачей современной медицины. Гиперчувствительность к плесневым грибам – важный этап в патогенезе не только АБЛА, но и тяжелой бронхиальной астмы с микогенной сенсибилизацией, аллергического микотического риносинусита и других хронических заболеваний органов дыхания. Своевременное выявление этих заболеваний необходимо для назначения адекватной противовоспалительной и антимикотической терапии. В том случае, когда выполнение провокационных исследований связано с риском развития системных реакций, а для проведения кожных проб имеются противопоказания и нет доступных аллергенов, особенно важны лабораторные методы аллергодиагностики.