fusarium oxysporum аллергия что это такое
Fusarium moniliforme (M9)
Описание исследования
Аллергическая реакция обуславливается выработкой большого количества специфических антител класса IgE. Они после первого попадания аллергена в организм человека продуцируются В-лимфоцитами. Характерной особенностью данных антител является то, что они связываются только с тем аллергеном, который спровоцировал их появление. Последующий механизм развития аллергической реакции таков:
Данное соединение приводит к разрыву тучных клеток и выбросу содержащихся в них биоактивных веществ, которые являются медиаторами аллергии (т.е. способствуют развитию локальной или генерализированной аллергической реакции).
Выявление специфических антител IgE и определение их количества позволяет диагностировать вероятность развития аллергии в дальнейшем и определять степень ее выраженности (чем выше концентрацция специфических антител Е в сыворотке крови пациента, тем больший риск развития реакции и тем более очевидными будут ее симптомы). Данный тест предназначен для выявления специфических антител класса IgЕ к плесени Fusarium moniliforme.
Fusarium moniliforme является представителем плесневых грибов. Он очень широко распространен в природе. Перечень растений-хозяев, которые поражаются этим плесневым грибом, зависит от места их произрастания. Наиболее часто фузариум паразитирует на рисе, сахарном тростнике, кукурузе, сое, фасоли, спарже, сорго, бобах, зерне пшеницы и ячменя. Находясь в земле, плесень часто образуется на корнях арбузов, помидоров, бананов и других овощных и плодовых культур. Наилучшим образом разрастается плесень Fusarium moniliforme в теплой и влажной почве. Fusarium moniliforme размножается спорами, которые ветром разносятся на значительные расстояния. Наиболее благоприятной для их «путешествия» является теплая влажная погода.
Попадание плесневого гриба в организм может стать причиной развития различных заболеваний. Например, при длительном употреблении в пищу зараженного Fusarium moniliforme зерна существует риск появления раковых опухолей (наиболее вероятно – рака пищевода). Токсинами плесневого гриба можно отравиться. Его присутствие в организме может вызвать развитие различных инфекций, в частности:
Наконец, у лиц с повышенной чувствительностью Fusarium moniliforme может спровоцировать появление симптомов:
Подготовка к исследованию
Тестирование рекомендуется проводить не ранее, чем через 4 часа после приема пищи. Разрешается пить негазированную воду. Чай, кофе, соки исключить.
На результаты обследования может оказать влияние прием препаратов глюкокортикоидных гормонов, поэтому необходимо проконсультироваться с аллергологом о возможности их временной отмены.
Важно! Прием антигистаминных (противоаллергических) препаратов не влияет на точность результатов тестирования. Результат также не зависит от особенностей возраста пациента.
Важно! За два дня до обследования рекомендуется прекратить прием препаратов витамина В7 и содержащих его пищевых добавок, т.к. избыток витамина может стать причиной получения ложноотрицательного результата.
Забор крови нежелательно проводить после ректального, мануального, ультразвукового, инструментального обследований физиопроцедур и других манипуляций.
Показания к исследованию
Тестирование предназначено для выявления сенсибилизации (повышенной чувствительности) к алергенам плеснового гриба Fusarium moniliforme у лиц со следующими заболеваниями:
Обследование проводится в следующих случаях:
Интерпретация исследования
Количество специфических антител класса IgE измеряется в килоединицах аллергена на литр (kU/I).
Нормой является уровень антител ниже 0,35 kU/L, что соответствует нулевому классу и результату «отрицательно».
Результат анализа выдается на бланке лаборатории. В графе «Нормы интерпретации» содержится описание классов проб с расшифровкой полученного показателя:
Fusarium oxysporum аллергия что это такое
Аллерген m9 – Fusarium proliferatum (F. moniliforme), IgE (ImmunoCAP) – метод диагностики гиперчувствительности к аллергенам плесневого гриба Fusarium proliferatum, основанный на определении в крови уровня специфичных к нему антител класса IgE.
Fusarium proliferatum (Fusarium moniliforme) (плесневый гриб, аллерген m9), IgE антитела, кровь
Fusarium moniliforme Allergy Test, Fusarium moniliforme (m9) IgE, IMMUNOCAP Fusarium prolifteratum/moniliforme IgE
Иммунофлюоресценция на твердой фазе (ImmunoCAP)
кЕдА/л (килоединица аллергена на литр)
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Достаточно широкая распространенность Fusarium proliferatum приводит к тому, что у предрасположенных лиц контакт с грибом вызывает развитие аллергических заболеваний, возникающих по типу реакций гиперчувствительности немедленного типа. Согласно результатам нескольких научных исследований, гиперсенсибилизация к аллергенам Fusarium proliferatum может вызывать симптомы аллергического ринита и бронхиальной астмы. Механизм развития таких реакций связан с выработкой в организме иммуноглобулинов класса Е. После первичного контакта с аллергеном В-лимфоциты продуцируют избыточное количество антител класса IgE, способных связываться исключительно с этим аллергеном. Синтезированные иммуноглобулины фиксируются на поверхности тучных клеток, а при повторном попадании аллергена в организм связываются с ним и стимулируют выброс биологически активных веществ – медиаторов аллергии. В результате этого происходит развитие локального аллергического воспаления. Измерение циркулирующих IgE-антител обеспечивает объективную оценку сенсибилизации к аллергену. На описанном механизме развития аллергии основаны методы лабораторной диагностики аллергических заболеваний путем обнаружения в крови повышенной концентрации иммуноглобулинов Е к определенному аллергену.
Современная технология ImmunoCAP является золотым стандартом выявления сенсибилизированных IgE. В тесте используется целлюлозная губка, в которой абсорбированы антигены Fusarium proliferatum. При добавлении исследуемой сыворотки, если в ней содержатся иммуноглобулины Е к аллергенам гриба, они свяжутся с абсорбированным антигеном в комплексы антиген-антитело. Чтобы обнаружить в губке иммунные комплексы, добавляют меченные флюоресцентным веществом антитела к иммуноглобулинам Е, которые окрашивают все образовавшиеся комплексы антиген-антитело флюоресцентным свечением. Интенсивность свечения оценивается специальным прибором и переводится в цифры, характеризующие концентрацию аллергенспецифичных иммуноглобулинов Е в крови.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Пациент считается сенсибилизированным к аллергену, если уровень специфичных иммуноглобулинов Е превышает порог в 0,35 кЕдА/л. Результаты ниже этого значения, соответственно, являются отрицательными.
Что может влиять на результат?
Циркулирующие в крови иммуноглобулины класса Е имеют сравнительно небольшую продолжительность жизни, поэтому в период ремиссии аллергических заболеваний за счет снижения их выработки возрастает вероятность получения отрицательного результата.
Кто назначает исследование?
Аллерголог, пульмонолог, терапевт, педиатр, врач общей практики.
Fusarium oxysporum аллергия что это такое
Fusarium spp. вызывают повреждение ногтевых пластинок (онихомикозы), которые впоследствии могут стать входными воротами диссеминированной инфекции у иммунокомпрометированных больных.
Инвазивный фузариоз чаще возникает у больных с нейтропенией, при трансплантации костного мозга.
Клиническая картина фузариоза. У 60—70 % больных фузариозом имеются множественные очаги на коже на фоне упорной лихорадки. Фузариоз кожи проявляется в виде гранулем, язв, пустул, некроза, очаговых инфильтратов; инвазия грибами может быть подобна ecthyma gangrenosum. Во всех случаях показаны биопсия этих образований, микологическое и гистологическое исследование.
Изолированное поражение легочной ткани Fusarium spp. наблюдается значительно реже, чем при аспергиллезе. В отличие от аспергиллеза и других плесневых микозов для грибов Fusarium spp. характерна высокая частота выделения их из крови (фунгемия), достигающая 50—60 %. Полиорганная диссеминация возникает часто, возможно поражение любого органа. Летальность при инвазивном фузариозе высокая, составляет более 70 %. Своевременно установить диагноз удается крайне редко, излечение возможно только при повышении (восстановлении) содержания лейкоцитов.
Лечение фузариоза. Препаратом выбора является вориконазол (вифенд). Активность препарата доказана в исследованиях in vitro и in vivo. Положительные результаты при терапии вориконазолом, включая диссеминированные формы фузариоза, отмечаются у 40— 50 % больных.
Вориконазол вводят внутривенно по 6 мг/кг каждые 12 ч в 1-й день, в последующие дни — по 4 мг/кг каждые 12 ч; пероральное применение при массе тела больного более 40 кг — 400 мг каждые 12 ч в 1-е сутки, далее по 200 мг каждые 12 ч. При массе тела менее 40 кг дозу пероральной формы уменьшают в 2 раза.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Fusarium oxysporum аллергия что это такое

Поиск
Грибы рода Fusarium как потенциально патогенные виды микроорганизмов
С.А. ЛИСОВСКАЯ, Е.В. ХАЛДЕЕВА
Казанский научно-исследовательский институт эпидемиологии и микробиологии Роспотребнадзора, 420015, г. Казань, ул. Большая Красная, д. 67
Лисовская Светлана Анатольевна ― кандидат биологических наук, ведущий научный сотрудник лаборатории микологии, тел. (843) 236-56-59, e-mail: [email protected]
Халдеева Елена Владимировна ― кандидат химических наук, заведующая лабораторией микологии, тел. (843) 236-56-59, e-mail: [email protected]
Ключевые слова: Fusarium spp., микромицеты, патогенность, адгезия, микроконидии.
S.A. LISOVSKAYA, E.V.KHALDEEVA
Kazan Research Institute of Epidemiology and Microbiology of the Russian Agency for Consumer Supervision, 67 Bolshaya Krasnaya Str., Kazan, Russian Federation, 420015
Micromycetes of Fusarium species as potentially pathogenic microorganisms
Lisovskaya S.A. ― Cand. Biol. Sc., Leading Researcher of Mycology Laboratory, tel. (843) 236-56-59, e-mail: [email protected]
Khaldeeva E.V. ― Cand. Chem. Sc., Head of Mycology Laboratory, tel. (843) 236-56-59, e-mail: [email protected]
Analysis of pathogenic activity of different species of Fusarium spp. was carried out. Adhesive properties of standard and clinical strains of Fusarium oxysporum, Fusarium solani were tested with the previously developed model based on nitrate cellulose film with immobilized hemoglobin. The growth activity of 5 strains was determined using various media. It was shown that microconidia demonstrated adhesive activity. All Fusarium species actively formed growth tubes on the nitrate cellulose film with immobilized hemoglobin. The obtained results make it possible to assume participation of Fusarium spp. in the disease pathogenesis.
Key words: Fusarium spp., micromycetes, pathogenity, adhesion, microconidia.
Повсеместное распространение микроскопических грибов в окружающей среде обуславливает постоянный контакт человека с микромицетами. Высокий уровень антропогенных воздействий, часто способствующий накоплению в окружающей среде вредных плесеней и увеличению количества больных иммунодефицитом, наиболее восприимчивых к возбудителям вторичных микозов, может способствовать увеличению риска заражения грибковыми инфекциями. Так, в последнее время увеличивается число регистрируемых случаев вторичных микозов, вызванных видами, ранее остававшимися в тени, относящихся к оппортунистическим ― потенциально патогенным видам из-за лабильных свойств [1]. Среди них есть и достаточно выраженные патогенные формы микромицетов, виды, способные поражать ослабленные организмы, и, наконец, сапрофиты, живущие на растительных остатках, в почве и на отмерших частях растений.
Грибы рода Fusarium обладают большим разнообразием ферментов, что позволяет им использовать в качестве субстрата различные органические соединения. Они способны, с одной стороны, длительно сохраняться и развиваться во внешней среде, а с другой, вызывать тяжелые формы заболеваний различных организмов. Большинство представителей грибов рода Fusarium являются фитопатогенами, однако известны Fusarium spp., паразитирующие на насекомых, а также вызывающие микозы и токсикозы человека и теплокровных животных [2, 3]. В последнее время в литературе появляется все больше сведений о клинических и эпидемиологических аспектах инфекции, вызванных Fusarium spp. [4].
Материалы и методы
В исследовании использовали клинические штаммы (Fusarium oxysporum, Fusarium solani), выделенные от пациентов, находящихся на амбулаторном лечении, и музейные штаммы, полученные из Всероссийской коллекции F. oxysporum ВКМ- F-1182 и F. Solani ВКМ- F-819.
Материал для выделения изолятов грибов брали от больных с помощью стерильного ватного тампона с последующим смывом стерильной водой по периметру наиболее свежих поражений. Затем тампон помещали в пробирку с 2 мл стерильной воды. Поверхностное культивирование проводили на агаризованных средах: стандартной среде Чапека, стандартной среде Сабуро и модифицированной среде Сабуро с добавлением гидролизат казеина. Выращивание проводили при +30±2 0 С в течение 6-9 суток. Идентификацию выделенных штаммов грибов проводили по основным принятым микроскопическим и биохимическим критериям [6, 7].
Определение адгезивных свойств выделенных штаммов Fusarium spp. проводилось на ранее разработанной авторами модели адгезии клеток гриба на нитроцеллюлозную пленку. Пленку площадью 7 см 2 инкубировали при температуре 30°С с 3 мл суспензии спор гриба в 0,1М фосфатном буфере в течение 1 суток. Определение уровня адгезии проводили по разнице начальной и конечной оптической плотности суспензии клеток при длине волны 540 нм, а также прямым подсчетом клеток в суспензии с помощью микроскопа Микмед-6 при увеличении 10×20, подсчитывали не менее 10 полей зрения.
Определение скорости роста мицелия грибов и прорастания микроконидий проводили на нитроцеллюлозной пленке с иммобилизованным гемоглобином и в его отсутствии. Густота посевной взвеси ― приблизительно 100 спор на пленку. Инкубирование проводили в течение 1-4 суток при температуре 30°С. Скорость прорастания микроконидий определяли временем достижения ростовой трубкой первого ветвления и числом ростковых трубок (в процентах; на основании изучения не менее чем 100 спор).
Результаты и обсуждения
Необходимо отметить, что данные микромицеты в 96% случаев в микробиологических посевах от больных высевались совместно с другими видами грибов. Наиболее часто, в 73% случаев Fusarium spp.встречался в ассоциациях с C. albicans.
Для исследования патогенности данных микромицетов нами были отобраны три клинических и два музейных штамма Fusarium spp. Группу клинических штаммов составили два штамма F. solani (№3, 4) и один штамм F. оxysporum (№5), при выделении которых учитывались клинические проявления микотического заболевания и выявление Fusarium spp. в количестве, превышающем 10 4 КОЕ/мл. Группу музейных штаммов составили два штамма: F. oxysporum (№1), F. solani (№2).
Рисунок 1. Частота встречаемости потенциально патогенных плесневых грибов в микологических посевах за период 2010-2015 гг.
Рисунок 2. Диаметр колоний изолятов Fusarium на различных твердых средах на четвертый день культивирования
Примечание: 1 ― стандартная среда Чапека; 2 ― стандартная среда Сабуро; 3 ― модифицированная среда Сабуро с добавлением гидролизат казеина
Потенциальную патогенность принято характеризовать наличием и проявлением факторов патогенности, основанных на физиологических особенностях грибковой клетки и характере ее взаимодействия с макроорганизмом, которые способствуют закреплению гриба в организме и развитию заболевания. Известно, что любой инфекционный процесс начинается с адгезии возбудителя на клетках-мишенях. Адгезивность является одним из основных факторов, определяющих поведение микроорганизмов в биоценозах, и она же определяет способность гетеротрофных микроорганизмов переходить к паразитическому образу существования [8]. Поэтому, нами были изучены адгезивные свойства штаммов грибов Fusarium spp., выделенных с поверхности кожи у больных атопическим дерматитом.
В изучении адгезивной активности штаммов использовали микроконидии, несмотря на то, что в морфологическом отношении они менее дифференцированы, чем макроконидии, но играют ключевую роль в распространении вида и заселении субстрата.
Изучение выделенных микроконидий у штаммов Fusarium spp. выявило значительные отличия в их адгезивных свойствах, связанных с видовой принадлежностью штаммов. Тестирование адгезивных свойств микроконидий грибов Fusarium spp., клинических и музейных штаммов показало значительно более высокий (почти в 2 раза) уровень адгезии у вида F. solani, по сравнению с F. oxysporum (табл. 1), что позволило выявить достоверные отличия между изученными видами. Таким образом, адгезивная активность микроконидий, по-видимому, является видовым атрибутом грибов рода Fusarium. Отсутствие отличий в адгезивной активности микроконидий у штаммов одного вида, но выделенных с различных источников, можно объяснить лишь тем, что каждый отдельный вид грибов рода имеет свои определенные особенности в структуре поверхности спор, участвующих в процессе сохранения и размножения вида.
Таблица 1.
Адгезивная активность микроконидий штаммов Fusarium spp. (n=5, p=0,95)
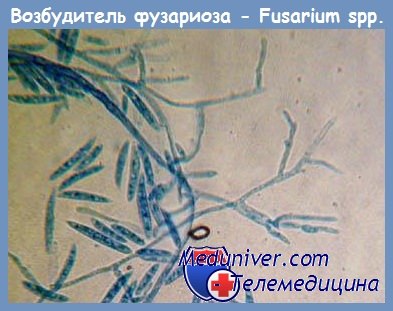




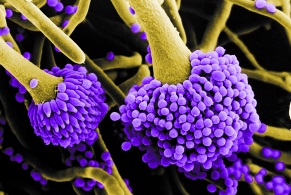 Грибы – источники аллергенов
Грибы – источники аллергенов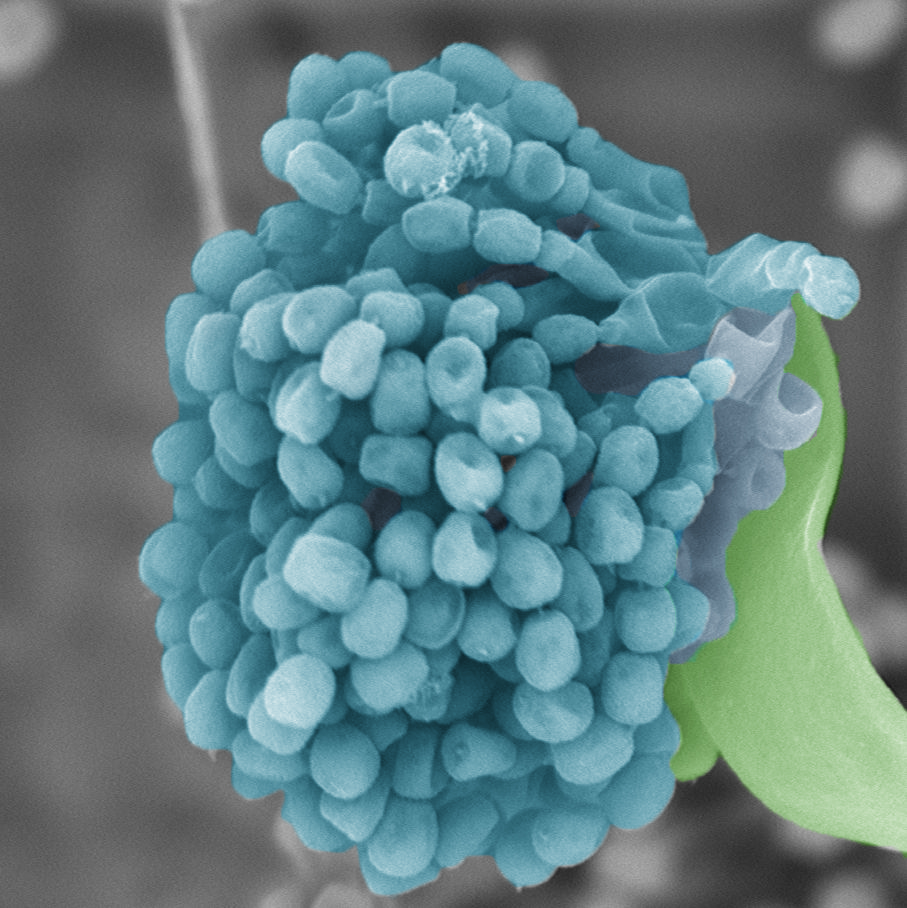
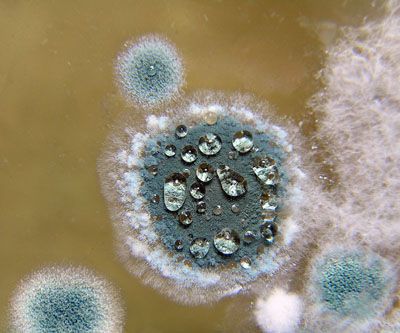 Основные представления о воздействии аллергенов плесневых грибов на организм человека были заложены в 20-х годах ХХ века. Storm van Leeuwen в Лейденском университете впервые исследовал влияние «климатических аллергенов» – плесневых грибов и бактерий – на формирование сенсибилизации у больных бронхиальной астмой. Storm van Leeuwen поместил больных БА, проживающих в домах, пораженных плесневыми грибами, в специальные помещения с «контролируемой окружающей средой». После этого у большинства больных была зарегистрирована ремиссия.
Основные представления о воздействии аллергенов плесневых грибов на организм человека были заложены в 20-х годах ХХ века. Storm van Leeuwen в Лейденском университете впервые исследовал влияние «климатических аллергенов» – плесневых грибов и бактерий – на формирование сенсибилизации у больных бронхиальной астмой. Storm van Leeuwen поместил больных БА, проживающих в домах, пораженных плесневыми грибами, в специальные помещения с «контролируемой окружающей средой». После этого у большинства больных была зарегистрирована ремиссия. Изучение клинико-иммунологических особенностей различных вариантов микогенной аллергии и выделение групп риска развития ТБАМС и АБЛА является важным направлением современной медицины. В отличие от аллергии на другие факторы окружающей среды, при грибковой сенсибилизации возможно применение специфической антимикотической терапии. Перспективным в лечении больных с микогенной аллергией является применением моноклональных анти- IgE антител. Однако данных в этой области пока не достаточно. Кроме того, в комплексном лечении различных клинических форм микогенной аллергии должны быть учтены следующие факторы: предотвращение контакта с микромицетами и уменьшение грибковой нагрузки, улучшение проходимости дыхательных путей за счет снижения количества слизи и уменьшения бронхообструкции, а также контроль над бактериальной инфекцией. Пациентам следует избегать деятельности, которая может привести к вдыханию большого количества грибковых спор, например, садоводство, сельскохозяйственная или фермерская работа, строительно-ремонтные работы, проживание рядом с компостными ямами и уборка пыльных помещений (подвалов, чердаков, старинных книг и архивов). Если такая деятельность неизбежна, то рекомендовано применение медицинских масок для уменьшения вдыхания спор.
Изучение клинико-иммунологических особенностей различных вариантов микогенной аллергии и выделение групп риска развития ТБАМС и АБЛА является важным направлением современной медицины. В отличие от аллергии на другие факторы окружающей среды, при грибковой сенсибилизации возможно применение специфической антимикотической терапии. Перспективным в лечении больных с микогенной аллергией является применением моноклональных анти- IgE антител. Однако данных в этой области пока не достаточно. Кроме того, в комплексном лечении различных клинических форм микогенной аллергии должны быть учтены следующие факторы: предотвращение контакта с микромицетами и уменьшение грибковой нагрузки, улучшение проходимости дыхательных путей за счет снижения количества слизи и уменьшения бронхообструкции, а также контроль над бактериальной инфекцией. Пациентам следует избегать деятельности, которая может привести к вдыханию большого количества грибковых спор, например, садоводство, сельскохозяйственная или фермерская работа, строительно-ремонтные работы, проживание рядом с компостными ямами и уборка пыльных помещений (подвалов, чердаков, старинных книг и архивов). Если такая деятельность неизбежна, то рекомендовано применение медицинских масок для уменьшения вдыхания спор.