isn лекарственных препаратов что это такое
Все о маркировке лекарственных препаратов
Зачем нужна маркировка?
По разным оценкам, от 2 до 10% медикаментов на фармацевтическом рынке – фальсификат или недоброкачественная продукция. Попадая в систему лекарственного обеспечения или в аптеки, такие «лекарства» представляют собой серьезные риски для здоровья людей. Чтобы обезопасить потребителей, по всему миру вводятся системы мониторинга для маркировки и прослеживания движения лекарств.
Система мониторинга – это, прежде всего, маркировка производителем упаковок с препаратами. Она позволяет контролировать качество каждой упаковки и отслеживать всю цепочку от конвейера до аптеки. Теперь покупателя не обманешь – он может сразу выяснить, настоящее ли лекарство у него в руках, при помощи приложения для смартфона.
С 1 февраля 2017 года в России проходит добровольный эксперимент по маркировке лекарств. В нем участвуют 16 организаций — производители, дистрибуторы, аптечные сети, лечебные учреждения — и 12 препаратов.
Маркировка лекарственных средств станет обязательной
Федеральный закон №425 от 28 декабря 2017 года «О внесении изменений в Федеральный закон «Об обращении лекарственных средств» в соответствии с которыми создаётся федеральная государственная информационная система мониторинга движения лекарственных препаратов от производителя до конечного потребителя с использованием в отношении лекарственных препаратов средств идентификации вступил в силу с 01.01.2018
Нормативный акт предусматривает, что с 1 января 2020 г. такими знаками должны быть снабжены все препараты. При этом Пункт 12 ФЗ № 425 дает Правительству РФ полномочия установить особенности и сроки внедрения системы маркировки для препаратов из Перечня ЖНВЛП и программы «Семь нозологий». Таким образом, у кабинета министров есть возможность ввести обязательную маркировку для этих лекарств до 2020 г., но не ранее 1 января 2019 г.
Кому потребуется маркировка?
Как происходит маркировка потребительской упаковки?
На вторичную (потребительскую) упаковку наносят двумерный штриховой код в формате Data Matrix ЕСС200 – рекомендуется размещать его на клапане коробки, как на рисунке. Он может быть напечатан или наклеен на упаковку.
Двумерный штриховой код в формате Data Matrix ЕСС200
Штрихкод содержит три обязательных группы данных:
Но есть и еще две группы данных – их включение остается на усмотрение эмитента КИЗ.
Как нужно маркировать транспортную упаковку?
Потребительские упаковки объединяются в третичную (заводскую, транспортную). Этот процесс называется агрегированием. В этом процессе важно сохранить информацию об уникальном идентификаторе каждой коробки с препаратом – чтобы их движение можно было проследить, не вскрывая групповую упаковку. Агрегирование бывает двух уровней:
На третичную упаковку (ее еще называют транспортной) тоже наносится КИЗ – линейный штрихкод в формате Code 128. Он бывает трех типов:
Что такое система маркировки лекарственных препаратов?
Цели внедрения системы маркировки лекарственных препаратов
— профилактика поступления в оборот и одномоментное изъятие из оборота в автоматизированном режиме на всей территории Российской Федерации недоброкачественных, а также фальсифицированных и контрафактных лекарственных препаратов на любом из этапов их обращения от производителя до конечного потребителя;
— профилактика неэффективных расходов и экономия бюджетных средств за счет невозможности реализации схем «повторного вброса» лекарственных препаратов, невозможности легальной реализации лекарственных препаратов, подлежащих предметно-количественному учету, а также не предназначенных для розничной продажи;
— контроль адресности движения препаратов, закупаемых за счет бюджета, расходов на их приобретение;
— мониторинг ценообразования и предельных розничных цен на лекарственные препараты из списка ЖНВЛП;
— оперативное планирование и управление запасами и резервами препаратов на всех уровнях, включая стратегический.
— снижение издержек за счет более эффективного управления логистикой;
— уменьшение упущенной выгоды, обусловленной контрафактной и фальсифицированной продукцией;
— соответствие требованиям для поставок продукции на международные рынки.
Кто является участниками системы маркировки лекарственных препаратов?
Как будет выглядеть маркировка лекарственных препаратов?
На вторичную (потребительскую) упаковку наносится контрольный (идентификационный) знак в виде двумерного штрихового кода, включающий:
На третичную (заводскую, транспортную) упаковку наносится контрольный (идентификационный) знак в виде линейного штрихового кода, содержащий различные данные в зависимости от типа.
Оборудование, необходимое аптечным организациям для участия в системе маркировки
Для участия в системе маркировки аптечной организации необходимо:
Какие санкции предусмотрены за производство и продажу лекарственных препаратов без средств идентификации?
За производство или продажу лекарственных препаратов для медицинского применения без нанесения средств идентификации, с нарушением установленного порядка их нанесения, а также за несвоевременное внесение данных в систему маркировки лекарственных препаратов для медицинского применения или внесение в нее недостоверных данных юридические лица и индивидуальные предприниматели несут ответственность в соответствии с законодательством Российской Федерации (ч.11* ст. 67 Федерального закона № 61-ФЗ от 12.04.2010 г. “Об обращении лекарственных средств”).
В соответствии со ст. 1 Федерального закона № 58-ФЗ* от 15.04.2019 г. «О внесении изменений в Кодекс Российской Федерации об административных правонарушениях» несвоевременное внесение данных в систему маркировки лекарственных препаратов для медицинского применения либо внесение в нее недостоверных данных влечет:
— наложение административного штрафа на должностных лиц в размере от пяти тысяч до десяти тысяч рублей;
Надеемся, что наша статья поможет разобраться в системе маркировки лекарственных препаратов не только владельцам и заведующим аптечных организаций, но и фармацевтам и провизорам!
Обязательные штрихкоды на упаковке
Обязательно ли должен номер GTIN совпадать со штрихкодом на упаковке препарата?
Безусловно да, так как штрихкод — это способ графической передачи сведений, идентифицирующих препарат.
Что такое GTIN?
GTIN — это глобальный идентификационный номер торговой единицы (Global Trade Item Number). Данный код позволяет идентифицировать производителя, торговое наименование лекарственного препарата, лекарственную форму, дозировку лекарственного средства и комплектность упаковки лекарства.
Штрихкод или штриховой код — это графическая информация, наносимая на поверхность, маркировку или упаковку изделий, предоставляющая возможность считывания ее техническими средствами; последовательность черных и белых полос либо других геометрических фигур.
Что такое DataMatrix?
Код DataMatrix, нанесенный на упаковку лекарственного препарата, имеет размерность 36 x 36 модулей, содержит информацию о коде маркировки лекарственного препарата и включает четыре группы данных 2 :
____________________
1 «Методические рекомендации для участников эксперимента по маркировке средствами идентификации и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения» (утв. Минздравом России 23.04.2018).
2 «Методические рекомендации по работе с маркированными лекарственными препаратами (версия 1.6)» (утв. Росздравнадзором) (вместе с Росздравнадзора от 16.01.2020 № 01и-71/20 «О розничной и оптовой торговле лекарственными препаратами»).
Партнер адвокатского бюро Forward Legal Ольга КАРПОВА.
Маркировка: основные действия аптеки в системе
Обзор вебинара с экспертом компании ЦРПТ — описание процессов от приемки лекарств до их отпуска
11 августа на нашем сайте состоялся вебинар, посвященный порядку действий работников аптек при работе с Государственной информационной системой маркировки движения лекарственных препаратов (ГИС МДЛП). О том, что необходимо для соблюдения законодательства и как именно нужно передавать данные в систему маркировки, рассказал представитель оператора системы маркировки компании «ЦРПТ» Дмитрий Кононов. Для тех, кто по каким‑либо причинам не смог принять участие в трансляции, мы публикуем краткое содержание вебинара, а также ответы на вопросы зрителей, заданные в прямом эфире.
Нормативные документы
Основной документ, который содержит все требования по маркировке, — это Постановление Правительства РФ № 1556. Не так давно в него были внесены изменения. Следует перечислить самые важные: теперь в систему нужно вносить данные в течение одного рабочего дня, а не пяти, как это было раньше. Сделано это для того, чтобы было удобнее получать оперативные ответы от поставщика. Т. е. при обратном акцепте аптеке не надо будет 5 дней ждать ответа от поставщика, чтобы начать работать с уже принятым товаром.
Обратите внимание, что дни рабочие. Их отсчет начинается на следующий день после получения лекарственных препаратов. Иными словам, если ЛС в аптеку привезли в пятницу вечером, то следующий рабочий день понедельник — значит, в течение этого дня (до вторника) все сведения должны быть в системе.
Еще одно важное изменение — корректировка формата взаимодействия информационных систем участников с МДЛП производится не чаще 1 раза в 180 дней. Это значит, что на законодательном уровне закреплено, что нельзя вносить в API системы маркировки изменения в течение полугода. Следовательно, если аптека настроила всё свое оборудование, то ей не придется проводить какую‑то переналадку или апгрейд каждую неделю или каждый месяц. 180 дней — довольно большой промежуток.
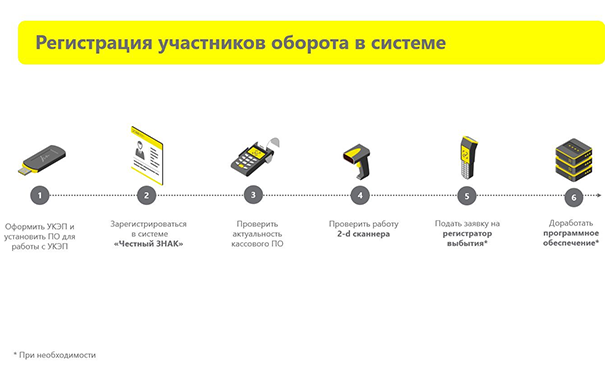
Регистрация в системе
Работа с системой ГИС МДЛП начинается с регистрации. Для этого нужен УКЭП. С его помощью руководитель организации в личном кабинете системы «Честный знак» регистрирует свою организацию. После этого он может там же добавить сотрудников, ответственных за работу с ГИС МДЛП, и дать им права на внесение информации в систему.
Следующий шаг — проверка актуальности программного обеспечения кассового оборудования. Это нужно, чтобы при отпуске через кассу данные направлялись автоматически. После этого необходимо проверить работу 2D-сканера для интеграции со своей товароучетной системой, которая будет передавать данные в ГИС МДЛП.
Если вы осуществляете отпуск бесплатно или со льготой, то необходимо еще подать заявку на получение регистратора выбытия. Подробнее о том, нужен ли вашей аптеке регистратор выбытия, читайте в нашем материале. И последний шаг — это доработка программного обеспечения, если это необходимо.
Прослеживаемость лекарств
Следует пояснить, как именно происходит отслеживание пути лекарственных препаратов. Производитель наносит на упаковку код DataMatrix. Таким образом он гарантирует уникальность упаковки и, соответственно, уникальность ЛС. Далее сведения о коде лекарственного препарата передаются в ГИС Маркировка.
Производитель, наравне с другими участниками системы, передает в нее данные об отгрузке или приемке товара. Он отгружает свои ЛС дистрибьютору, а тот уже вносит в систему свою часть информации о поступивших лекарствах. После этого он отгружает их в аптеку или медицинскую организацию. Далее уже аптека или больница фиксируют выбытие или продажу ЛС.
Что вообще такое код DataMatrix? Он очень похож на QR-код, но значительно отличается от него. Подробные отличия описаны на иллюстрации:
GTIN — это «зашифрованное» наименование лекарственного препарата. В нем указаны название ЛС, лекарственная форма и дозировка. Индивидуальный серийный номер торговой единицы — это дополнение с информацией о серии. Эти два параметра объединяются в один код, называемый SGTIN. Именно он отправляется в систему ГИС МДЛП для отслеживания препаратов в товаропроводящей цепи.
Далее идут ключ проверки и значение кода проверки, которые отвечают за уникальность самого кода DataMatrix и гарантируют, что он не поддельный.
Следующий тип кодов, с которыми можно столкнуться при работе с системой маркировки, это код SSCC — серийный код транспортной упаковки (агрегирующий код). Другими словами, код групповой упаковки, или «код коробки» в которой объединено несколько препаратов при транспортировке. Визуально он представляет собой линейный штриховой код длиной 18 знаков. При этом он всегда начинается с «00». Если вам приходит упаковка с SSCC, то приемку нужно осуществлять по групповой упаковке.
Документы для работы в системе
Оператор системы регулярно старается публиковать более легкие для восприятия инструкции, чем официальные документы. Можно выделить четыре типа таких документов, доступных на сайте «Честный знак»:
Кроме этого, на сайте есть раздел «Обучающий центр», где даны краткие, но подробные видеоинструкции по основным направлениям работы с системой ГИС Маркировка.
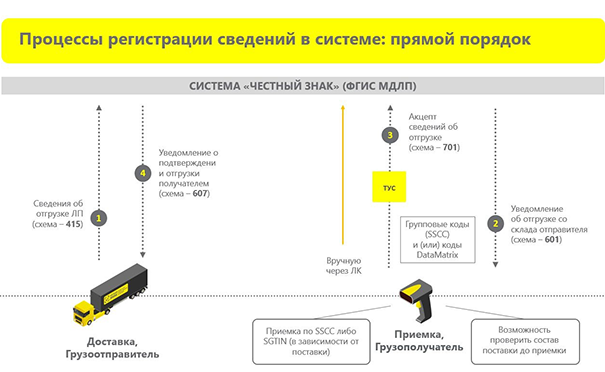
Регистрация сведений в системе МДЛП: прямой порядок (прямой акцепт)
Перейдем к работе в системе и к первому действию — получению товара по прямому акцепту. В этом случае у нас есть грузоотправитель и грузополучатель. Грузоотправитель при прямом порядке формирует условную «коробку» с лекарственными препаратами. Также именно грузоотправитель формирует начальный документ сведений об отгрузке (схема 415). Отправив этот документ, грузоотправитель передает лекарственные препараты в сторону грузополучателя.
Далее система формирует уведомление об отгрузке со склада отправителя. С этого момента грузополучатель знает, что ему должен прийти товар от отправителя по прямому акцепту. Затем по приходе товара у грузополучателя есть один рабочий день для формирования сведений об отгрузке (схема 701). Для этого нужно просканировать групповые коды SSCC, если лекарства пришли в групповой упаковке. Если нет, то необходимо просканировать каждую упаковку.
Затем система формирует уведомление о получении товара. Таким образом, лекарства, образно выражаясь, «встают на баланс аптеки». После этого ими уже можно распоряжаться по своему усмотрению — перемещать между своими организациями, отпускать, продавать и так далее. Таким образом, прямой порядок — от грузоотправителя получателю.
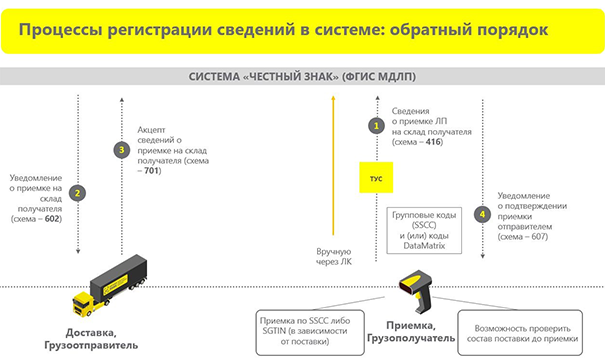
Регистрация сведений в системе МДЛП: обратный порядок (обратный акцепт)
При таком варианте поставок грузоотправитель формирует товар для аптеки и отправляет его, не передавая при этом данные в систему МДЛП. Товар приходит в аптеку, и с этого момента, всё так же в течение одного рабочего дня, нужно сформировать сведения о приемке ЛС (схема 416).
Для этого также необходимо просканировать коды — групповые или у каждой упаковки. Затем грузоотправитель уже получает уведомление, что его товар принят на склад. Он, в свою очередь, смотрит на полученные коды и проверяет по своей накладной. Если всё в порядке, то он отправляет в систему акцепт о приемке, который превращается в уведомление о подтверждении приемки товара. После этого лекарства становятся собственностью аптечной организации.
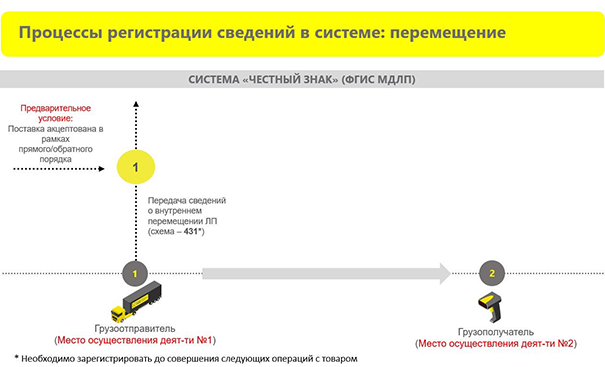
Регистрация сведений в системе: перемещение
Такой вид сведений в первую очередь касается аптечных сетей. Перемещения лекарственных препаратов между собственными местами осуществления деятельности описаны на схеме 431. При этом подтверждения от получателя не требуется, поскольку перемещение происходит между вашими зарегистрированными местами деятельности.
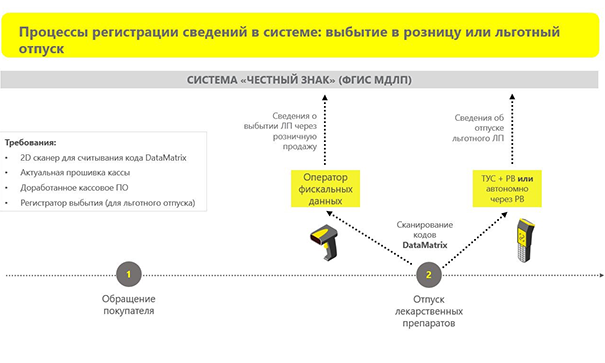
Выбытие в розницу или льготный отпуск
После приемки или перемещения ЛС можно осуществить выбытие лекарств. Если это не льготный отпуск, то понадобится только оператор фискальных данных. Сканирование упаковки автоматически формирует необходимые сведения о выбытии, которые передаются в систему. Поэтому обязательно проверьте актуальную версию программного обеспечения и прошивки кассового аппарата.
Льготный отпуск происходит через регистратор выбытия — именно им надо сканировать код DataMatrix.
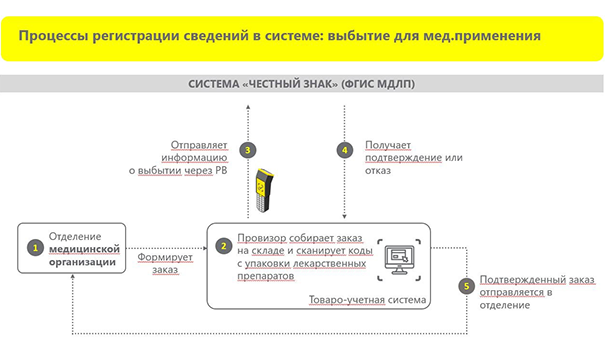
Выбытие для медицинского применения
Процесс отпуска препарата в больничной аптеке можно описать следующей схемой:
Это основные процессы, с которыми может столкнуться аптека в своей повседневной деятельности.
При возникновении каких‑либо трудностей пишите в Службу технической поддержки по адресу support@crpt.ru или звоните по телефону 8 800 222 15 23, описывая во всех подробностях вашу проблему. Каждому обращению присваивается свой уникальный номер, и оно в обязательном порядке будет рассмотрено специалистами.
Ответы на вопросы зрителей вебинара:
В аптечном пункте автономная касса. Как нужно передавать сведения в систему МДЛП о продаже?
Любая автономная касса может передавать накопленные данные при наличии интернета. Если такой возможности нет, то сведения о розничной продаже могут быть переданы через схему 511.
Как быть, если образовался пересорт маркированного товара?
От этого никто не застрахован. Наиболее эффективное средство борьбы с этим — прямой акцепт. Тогда можно не подтверждать прием «лишних препаратов». Также можно написать в Службу технической поддержки.
Нужно ли наносить внутренний штрихкод аптеки на маркированный товар?
Если ваша система обучена работать с DataMatrix, то можно не наносить. Если ваша система так устроена, что наличие внутреннего кода необходимо, то это не запрещается. Единственный момент, что ваш код никаким образом не должен мешать считыванию DataMatrix.
Почему нужно обязательно ходить и ловить спутники ГЛОНАСС?
Синхронизация регистраторов выбытия с системой ГЛОНАСС нужна для того, чтобы регистрировать место совершения действия и, самое главное, время совершения действия. Таким образом, эту информацию нельзя подделать, и она всегда будет корректна. Если качество соединения по каким‑то причинам оставляет желать лучшего, то можно написать в Службу технической поддержки. Возможно, вам следует подобрать более оптимальный вариант регистратора.
Ошибка «КИЗ»: некорректное состояние. Не можем промаркировать товар. Что делать?
С таким вопросом следует обратиться в Службу технической поддержки, с указанием вашей организации и SGTIN, с которым возникает ошибка. Причин может быть несколько. Для этого нужно полное описание процесса, который вы выполняете.
Как проверить актуальность кассового ПО?
В первую очередь — узнать у поставщика ПО. Кроме этого, на сайте «Честный знак» есть список поставщиков, программное обеспечение которых уже прошло проверку на совместимость с ГИС МДЛП.
Проблема с ответом от поставщика по прямому акцепту!
В первую очередь нужно связаться с поставщиком и узнать о причинах задержки. Если же связи нет, то нужно написать в Службу технической поддержки — все проблемы решаемы.
Как передавать данные аптекам, которые работают в автономном режиме?
Если ваша местность отнесена к местам, отдаленным от сетей связи, то в этом случае информацию о выведении ЛС из оборота может осуществлять головная организация. Если же интернет есть, но плохой, то все‑таки придется искать возможности работать онлайн.
Льготный рецепт — при использовании регистратора выбытия документ создается на каждый льготный препарат?
При отпуске по льготе с помощью регистратора выбытия вы получаете рецепт на руки, вводите в регистратор номер рецепта и по этому рецепту выводите все препараты, указанные в рецепте.
Поставщики присылают товар, а мы распределяем его по подведомственной сети. Эти места деятельности надо регистрировать в системе?
Есть ли инструкции по ревизии маркированного товара?
Да, они есть в методических рекомендациях (см. выше).
Кто, кроме получателя, знает день прихода товара?
Логистическая компания, получатель, отправитель и другие участники товаропроводящей цепи.
Если ИП решил стать юридическим лицом, то как быть с товаром, который зарегистрирован на ИП?
Следует начать с того, что все изменения вносятся в лицензию. Вариантов смены типа организации может быть много. Напишите о своем случае в Службу технической поддержки, и вам подскажут алгоритм действий. Что касается ЛС, то они будут «привязаны» к новой лицензии.
Как оформлять в системе отпуск по безналу для организаций?
Для этого у вас должна быть лицензия на оптовую торговлю. Если у вас такая лицензия есть, то нужно оформить как перемещение ЛС в другую организацию — схемы 415 и 416, о которых уже говорилось ранее.
Как быть, если в товаре привезли пересорт или ненадлежащее качество?
Товар ненадлежащего качества можно не принимать — вы не указываете его в документах и осуществляете возврат — схема 252 «Отказ от приемки товара». А сам вопрос по качеству товара нужно урегулировать с поставщиком.
Как быть с недовозом или браком?
Как и в предыдущем случае, нужно формировать отказ от приемки товара.
Если поставщик не подтвердит получение одной позиции — вся накладная «повиснет»?
Если поставщик подтверждает приемку всей групповой упаковки, то, к сожалению, да. Если приемка проводилась по отдельным позициям — то можно будет подтвердить все остальные.
Как оформить списание товара?
Для этого есть специальная схема, указанная в методических рекомендациях.
При прямом акцепте поставщик выбрал неправильное место деятельности. Что делать получателю?
Можно отказаться от приемки и попросить поставщика исправить документ, указав верный идентификатор места. Это нужно сделать на этапе получения уведомления о направлении товара.
Что такое «реестр ожиданий»?
Это специальный инструмент ГИС МДПЛ, который фиксирует документы на выбытие и при отсутствии документов предыдущего порядка (например, приемки этого товара) помещает его в специальный реестр. Там эти данные ожидают получения информации о всей товаропроводящей цепи.
Читайте больше полезного о маркировке лекарственных препаратов в специальной рубрике на нашем сайте.
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.
Референтные и взаимозаменяемые лекарственные препараты в Государственном реестре лекарственных средств
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Информация о лекарственных средствах (ЛС) и организация системы информационной обеспеченности сведениями о ЛС являются важными факторами, влияющими на компетентность и информированность медицинских кадров по вопросам рационального использования лекарственных препаратов (ЛП). Эта проблема включает несколько направлений, в т. ч. использование ЛС с доказанной эффективностью и безопасностью и возможность предупреждения нежелательных побочных реакций. По ряду причин специалисты системы здравоохранения в РФ зачастую не владеют объективной и оперативной профессиональной информацией о ЛС в связи с увеличением количества обращающихся на фармацевтическом рынке ЛП, преобладанием воспроизведенных препаратов отечественного и импортного производства и отсутствием доступных информационных баз данных об их взаимозаменяемости с референтными препаратами.
Ввиду значимости данных вопросов авторы провели изучение информированности медицинских работников Иркутской области по вопросам референтности и взаимозаменяемости ЛП, а также провели анализ возможностей работы в системе Государственного реестра ЛС. В результате был разработан и предложен алгоритм работы с данным информационным ресурсом (получение информации о референтности того или иного ЛП, поиск взаимозаменяемых ЛП).
Ключевые слова: рациональное использование лекарственных средств, референтный лекарственный препарат, взаимозаменяемость, Государственный реестр лекарственных средств.
Для цитирования: Ковальская Г.Н., Михалевич Е.Н. Референтные и взаимозаменяемые лекарственные препараты в Государственном реестре лекарственных средств. РМЖ. 2019;8(I):65-69.
Reference and interchangeable medicinal products in the State Register of Medicines
G.N. Kovalskaya, E.N. Mikhalevich
Irkutsk State Medical Academy of Postgraduate Education — the branch of the Russian Medical Academy of Continuous Professional Education
Information on pharmaceutical products (PP) and organization of the information security system on PP data are important factors affecting the competence and awareness of medical personnel on the rational use of medicinal products (MP). This problem includes several areas, including the PP use with proven efficacy and safety, and the ability to prevent unwanted adverse events. For a number of reasons, health care specialists in the Russian Federation often do not possess objective and timely professional information on PP due to the increase in the number of tradeable MP in the pharmaceutical market (with the reproduced drugs predominance of domestic and foreign production and the lack of available information databases on their interchangeability with reference products). Due to these issues importance, the authors conducted a study on medical workers (Irkutsk region) awareness on the reference and interchangeability issues of MP, and also analyzed the possibilities of o perating in the State Register of Medicines system. As a work result, an algorithm for operating with this information resource was developed and proposed (obtaining information about the particular MP reference, searching for interchangeable MP).
Keywords: rational use of medicinal products, reference medicinal product, interchangeability, State Register of Medicines.
For citation: Kovalskaya G.N., Mikhalevich E.N. Reference and interchangeable medicinal products in the State Register of Medicines. RMJ. 2019;8(I):65–69.
В статье рассмотрены референтные и взаимозаменяемые лекарственные препараты в Государственном реестре лекарственных средств. Предложен алгоритм работы с данным информационным ресурсом.
Введение
В соответствии с рекомендациями ВОЗ национальные регулирующие органы в сфере обращения лекарственных средств (ЛС) в РФ в последние годы уделяют особое внимание созданию системы рационального использования ЛС. Регламентирующим документом Министерства здравоохранения РФ определена Стратегия лекарственного обеспечения населения до 2025 г., которая утверждена приказом Минздрава от 13 февраля 2013 г. № 66 (ред. от 7 апреля 2016 г.) «Об утверждении Стратегии лекарственного обеспечения населения Российской Федерации на период до 2025 года и плана ее реализации».
Одним из ключевых положений системы рационального использования служит независимая объективная профессиональная информация о ЛС, что является важным фактором, влияющим на компетентность и информированность медицинских кадров. Проблема рационального использования ЛС включает несколько направлений, в т. ч. использование ЛС с доказанной эффективностью и безопасностью и возможность предупреждения нежелательных побочных реакций ЛС [2].
По ряду причин специалисты системы здравоохранения в РФ зачастую не владеют объективной и оперативной профессиональной информацией о ЛС в связи с увеличением количества обращающихся лекарственных препаратов (ЛП) на фармацевтическом рынке, преобладанием воспроизведенных препаратов отечественного и импортного производства и с отсутствием доступных информационных баз данных об их взаимозаменяемости с референтными препаратами [3].
В соответствии с федеральными законами от 12.04.2010 г. № 61-ФЗ «Об обращении лекарственных средств» и от 22.12.2014 г. № 429-ФЗ «О внесении изменений в Федеральный закон «Об обращении лекарственных средств» в РФ отменен термин «оригинальное лекарственное средство» и введены новые понятия: «референтный лекарственный препарат», «взаимозаменяемые лекарственные препараты». Изменена формулировка понятия «воспроизведенный лекарственный препарат» и впервые введена статья 27.1 «Порядок определения взаимозаменяемости лекарственных препаратов для медицинского применения».
Согласно ряду исследований наиболее эффективным и безопасным ЛП среди всех торговых наименований, соответствующих одному международному непатентованному наименованию (МНН), является референтный ЛП. Однако применение воспроизведенного ЛП вместо референтного ЛП даже по экономическим соображениям может быть оправдано лишь в том случае, если специалист убежден, что это не снизит эффективность и безопасность фармакотерапии.
В соответствии с действующим приказом Министерства здравоохранения Российской Федерации от 14.01.2019 г. № 4н «Об утверждении порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения» «назначение лекарственных препаратов осуществляется медицинским работником по международному непатентованному наименованию (МНН), а при его отсутствии — по группировочному или химическому наименованию. В случае отсутствия МНН и группировочного или химического наименования лекарственного препарата лекарственный препарат назначается медицинским работником по торговому наименованию» [4]. Если раньше в выборе конкретного ЛП определяющую роль могла играть лояльность лечащего врача к тому или иному ЛП, то сегодня этим фактором становятся личные предпочтения покупателя вкупе с рекомендациями специалиста аптеки, занимающегося отпуском ЛП.
Перспективы решения этих вопросов с целью повышения качества фармацевтической помощи обозначены в распоряжении Правительства РФ от 12.01.2018 г. № 9-р «Развитие конкуренции в здравоохранении», в котором был утвержден план мероприятий («дорожная карта»). Этим планом предусмотрено внесение целого ряда изменений в нормативно-правовое регулирование, касающееся взаимозаменяемости ЛП в частности. Среди прочего «дорожная карта» предусматривает обеспечение функционирования института взаимозаменяемости ЛП, включая формирование списка референтных ЛП, формирование реестра типовых инструкций по применению взаимозаменяемых ЛП.
В РФ среди официальных информационных источников о ЛС первую позицию занимает онлайн-ресурс «Государственный реестр лекарственных средств» (ГРЛС) как независимый, точный, структурированный, объективный и проверенный источник информации. ГРЛС — это издание Минздрава России, включающее перечень отечественных и зарубежных ЛС (ЛП и фармацевтических субстанций), разрешенных к медицинскому применению в нашей стране. Каждому зарегистрированному в РФ ЛП соответствует страница в системе ГРЛС.
ГРЛС содержит перечень ЛП, прошедших государственную регистрацию, при этом на все ЛП представлены регистрационные удостоверения из 12 разделов, позволяющие получить следующую информацию:
Номер регистрационного удостоверения, дата
регистрации, дата переоформления, срок введения в гражданский оборот.
Наименование держателя или владельца регистрационного удостоверения с указанием страны.
Торговое наименование ЛП.
Международное непатентованное, или группировочное, или химическое наименование.
Форма выпуска с указанием лекарственной формы, дозировки, срока годности, условий хранения.
Сведения о стадиях производства, включая стадии производства, адрес производителя, производителя, страну.
Инструкция по применению ЛП через активную клавишу «Показать инструкцию».
Нормативные документы с указанием номера нормативного документа, года, номера изменения.
Анатомо-терапевтическая химическая классификация с указанием кода ЛП.
Фармацевтическая субстанция с указанием международного непатентованного, или группировочного, или химического наименования, производителя, адреса производителя.
Особые отметки включают: наличие ЛП в перечне жизненно необходимых и важнейших ЛС; наличие в ЛП наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в РФ в соответствии с законодательством РФ, международными договорами РФ, в т. ч. Единой конвенцией о наркотических средствах 1961 г. и Конвенцией о психотропных веществах 1971 г.; референтность и взаимозаменяемость ЛП.
Большим преимуществом использования ресурса ГРЛС для получения информации о ЛП является то, что на нем представлены сведения о регистрации и перерегистрации, о производителях на всех стадиях производства, сведения о фармацевтической субстанции и сканированный вариант инструкции по применению ЛП от разработчика. Кроме того, ресурс содержит ценную информацию о наличии данного ЛП в перечне жизненно необходимых и важнейших ЛС, о референтном ЛП, взаимозаменяемости ЛП, о дате перерегистрации ЛП, которая на сегодняшний день в систематизированном виде более нигде не представлена.
Ввиду большой значимости обозначенных вопросов авторами было проведено изучение информированности медицинских работников Иркутской области по вопросам референтности и взаимозаменяемости ЛП, а также проведен анализ вариантов поисковой работы в системе ГРЛС.
Исследование по изучению информированности медицинских работников по вопросам референтности и взаимозаменяемости ЛП
Цель исследования: изучить уровень информированности врачей по вопросам поиска объективной и оперативной информации о ЛП.
Материалы и методы: для проведения исследования был выбран метод анкетирования, разработана анкета из 18 вопросов, включающая в себя несколько разделов. В исследовании приняли участие 110 врачей различных специальностей, работающих в Иркутской области.
Результаты исследования: сотрудники кафедры фармации ИГМАПО провели анонимное анкетирование врачей различных специальностей: терапевтов (26,7%), педиатров (25,0%), неврологов (27,0%), психиатров (9,3%), дерматовенерологов (1,3%), гинекологов (1,0%) и др.
Несмотря на то, что 95,2% респондентов регулярно используют в своей работе справочную информацию о ЛС, всего 14,5% врачей знакомы с онлайн-ресурсом ГРЛС.
На вопрос «Оцените свой уровень знаний по работе в системе ГРЛС» респонденты ответили следующим образом: высокий — 0%, достаточный — 1%, недостаточный — 20%, низкий — 66%, затрудняюсь ответить — 13%.
Исследование показало, что подавляющее большинство опрошенных имеют потребность в систематизации знаний по работе с системой ГРЛС.
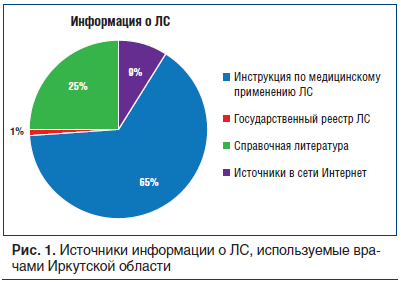
В своей работе специалисты используют следующие источники информации о ЛС (рис. 1):
инструкция по медицинскому применению ЛС — 65%;
справочная литература — 25%;
источники в сети Интернет — 9%;
Первые три источника информации нельзя абсолютно отнести к официальным источникам информации. Первый источник отличается тем, что производитель может исключить из инструкции часть информации по своему усмотрению, объективная информация содержится только в инструкции, предназначенной для специалистов. Второй и третий ресурсы относятся к общим источникам информации и не отвечают современным требованиям объективности и независимости, поэтому не могут использоваться специалистами для рационального применения ЛС.
Таким образом, изучение мнения врачей убедительно доказывает необходимость совершенствования знаний о ресурсе ГРЛС и навыков работы в нем.
Алгоритмы работы с ГРЛС
Авторы разработали несколько алгоритмов работы с ГРЛС.
В случае, если врачу нужно получить информацию о референтности того или иного ЛП, он может осуществить поиск по следующему алгоритму:
В разделе ГРЛС «Лекарственные препараты» в строку поиска ввести МНН ЛП. В виде таблицы отображаются все зарегистрированные ЛП, содержащие ЛС под данным МНН. Если известен производитель, а также торговое наименование данного ЛП, поиск можно сузить, введя известную информацию в соответствующие строки.
Выбрав в таблице строку с искомым ЛП, пользователь переходит на страницу регистрационного удостоверения. В разделе 12 «Особые отметки» отображается информация о референтности ЛП.
В качестве примера получим информацию о референтном ЛП для ЛС дутастерид, который является селективным ингибитором 5-альфа редуктазы. В строку поиска в разделе «Государственный реестр лекарственных средств» вводим МНН — «дутастерид», появляется таблица с результатом поиска, включающим три ЛП. Перейдя на страницу регистрационного удостоверения первого ЛП (Гардиум, производитель «Тева Фармацевтические Предприятия Лтд», Израиль), в разделе «Особые отметки» находим информацию о том, что данный ЛП не является референтным, по активной ссылке переходим на страницу регистрационного удостоверения референтного ЛП (рис. 2).
В случае, когда врачу необходимо подобрать соответствующий известному референтному взаимозаменяемый ЛП, он может осуществить поиск по предлагаемому алгоритму:
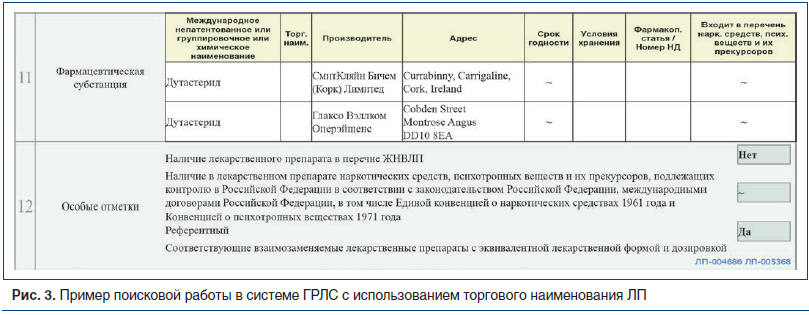
В разделе ГРЛС «Лекарственные препараты» в строку поиска ввести торговое наименование известного референтного ЛП. В виде таблицы отображаются все формы выпуска данного референтного ЛП. Выбрав нужную строку, пользователь переходит на страницу регистрационного удостоверения. В разделе 12 «Особые отметки» отображается информация о взаимозаменяемых ЛП в виде ссылок на регистрационные удостоверения соответствующих ЛП.
В качестве примера осуществим поиск взаимозаменяемых ЛП для препарата Аводарт ® (МНН дутастерид). В строку поиска в разделе «Государственный реестр лекарственных средств» вводим торговое наименование — «Аводарт». В таблице с результатом поиска выбираем ЛП в нужной нам лекарственной форме — «капсулы». Открыв регистрационное удостоверение данного ЛП, переходим в раздел 12, где отображается признак референтности и располагаются активные ссылки на соответствующие взаимозаменяемые ЛП с эквивалентной лекарственной формой и дозировкой (рис. 3).
Перейдя по активным ссылкам, узнаем торговые наименования взаимозаменяемых ЛП — Гардиум, Дутастерид Бактер.
Заключение
Анализ полученных данных позволяет сделать вывод о том, что врачи на сегодняшний день недостаточно информированы и не владеют навыками поиска необходимой объективной и независимой информации о ЛП. В то же время такая информация крайне важна для назначения правильного лечения, получения хороших результатов терапии. При этом необходимо учитывать такой фактор, как повышение приверженности пациентов лечению, который складывается из результативности терапии и оптимального соотношения цены и качества ЛП. Используя в повседневной практике данные ГРЛС, пользователь может получить достоверную, полную и оперативную информацию о ЛП, их референтности и взаимозаменяемости. Повышение уровня знаний о ресурсе ГРЛС и навыков работы в нем позволит улучшить качество подбора, проведения и коррекции лекарственной терапии и, как следствие, будет способствовать развитию в РФ системы рационального использования ЛС.
Только для зарегистрированных пользователей