Левоноргестрел или дидрогестерон что лучше
Индивидуализация выбора заместительной гормональной терапии с учетом разных типов климактерических расстройств (с преимущественным дефицитом эстрогенов и андрогенов, по смешанному типу)
СЮ.Калинченко, С.С.Апетов
Кафедра эндокринологии ФПКМР ГБОУ ВПО РУДН, Москва
В настоящее время существуют разные классификации климактерического синдрома (по тяжести, времени возникновения и пр.), но по сути ни одна из них не учитывает индивидуальных особенностей течения данной патологии, которая в своих клинических проявлениях бывает весьма вариабельной.
Так, некоторых женщин беспокоят преимущественно приливы жара, повышенное потоотделение, прибавка массы тела и артериальная гипертензия. У других эти жалобы отсутствуют, но они отмечают постоянную необъяснимую слабость, повышенную утомляемость, упадок жизненных сил, психоэмоциональные и сексуальные расстройства, разные нарушения мочеиспускания. У третьих присутствуют и те и другие жалобы.
Почему остеопороз развивается только у 45% женщин в постменопаузе, хотя дефицит эстрогенов есть у 100%? Почему ожирение у 60, приливы у 65%? В доступной медицинской литературе мы не встретили убедительного объяснения такой вариабельной клинической картины у разных женщин.
В то же время в последнее десятилетие ряд зарубежных исследований 2, а также наши собственные наблюдения 10 показали негативное влияние андро-генного дефицита и позитивное влияние его коррекции (или его отсутствия) на течение разных проявлений климактерического синдрома.
Проявления андрогенной недостаточности
К ним относят следующие симптомы (группы симптомов):
Костно-мышечные:
• снижение мышечной массы;
• неадекватный физическим нагрузкам прирост мышечной массы;
• боли в костях, суставах;
• мышечные боли.
Психоэмоцион альные:
• быстрая утомляемость;
• лабильность настроения со склонностью к депрессиям;
• нарушение памяти;
• снижение творческой продуктивности;
• снижение мотивации и самооценки;
• расстройство сна, не связанное с приливами.
Сексуальные:
• снижение либидо;
• возбуждаемости;
• чувствительности эрогенных зон;
• возможности достижения оргазма.
Кожные:
• сухость кожи;
• выпадение волос на лобке;
• гипотония мимических мышц (появление носогубного треугольника, опускание углов рта)
Типы климактерических расстройств
Согласно нашим наблюдениям и проведенным исследованиям можно выделить 3 клинических типа климактерических расстройств у женщин в период пери-менопаузы:
Сравнительная характеристика симптомов в зависимости от типа течения перименопаузы представлена в табл. 1.
Таблица 1. Клинические симптомы и типы течения климактерических расстройств
Клинический признак
Приливы жара, потливость
Проблемы со
сном, не связанные с приливами
Раздражительность, нервозность, тревожность, сниженная самооценка
Сексуальные расстройства
Вагинальная атрофия
Ноктурия
Висцеральное ожирение
Остеопороз
Боли в суставах и мышцах, снижение мышечного тонуса и силы
Пациентки с разными типами климактерических расстройств имеют различные антропометрические и конституциональные характеристики.
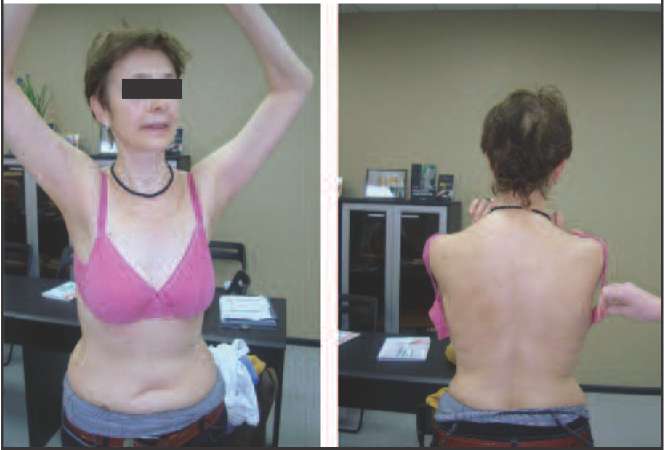
Так, к 1-му типу, протекающему с преимущественным снижением эстрогенов (эстроген-дефицитный тип), можно отнести пациенток, у которых не происходит выраженной прибавки массы тела, не характерно висцеральное ожирение, нет снижения либидо, благодаря чему они сохраняют сексуальную активность, нет депрессии и нарушения мочеиспускания, поэтому при данном типе климактерических расстройств пациентки зачастую продолжают работать и жить активной жизнью (рис. 1).
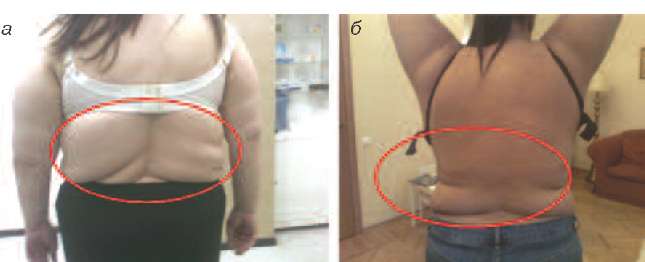
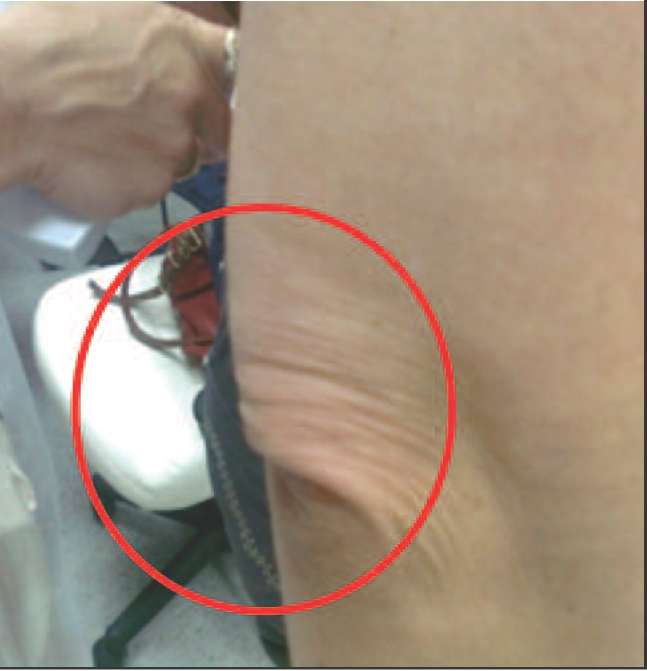
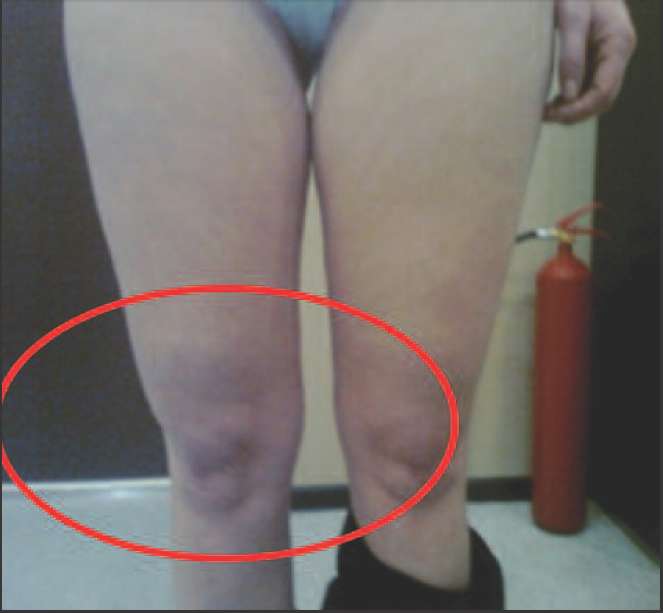
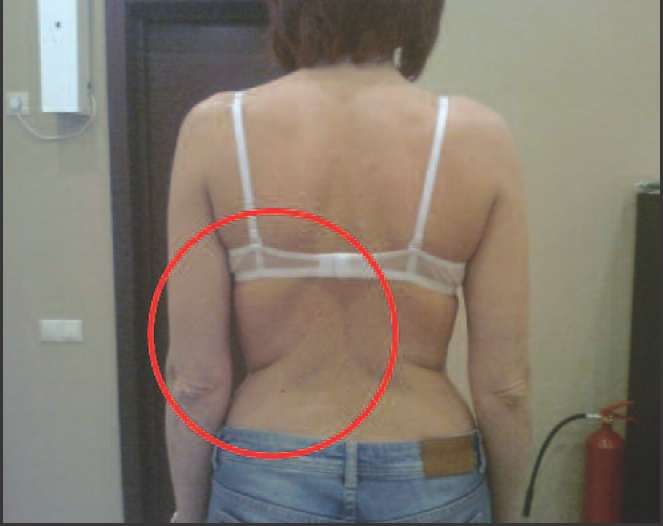
Ко 2 типу, протекающему преимущественно со снижением андрогенов (андроген-дефицитный тип) можно отнести пациенток, у которых в климактерии происходит прибавка массы тела преимущественно за счет отложения жира в области талии и живота (центральное, или висцеральное ожирение), отмечается гипотония мышц, что проявляется в провисании трицепса, появлении характерных складок на спине в виде «ламбрекенов», провисании передней группы мышц бедра (рис. 2-5).
Рис. 2. Пациентки 2-го типа (андроген-дефицитный): видны кожные складки на спине, являющиеся признаком гипотонии мышц спины вследствие дефицита андрогенов.
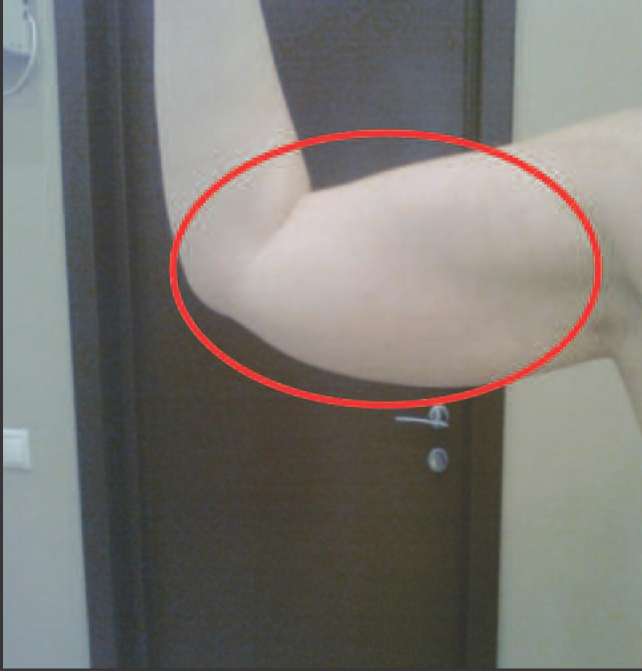
Рис. 3. Провисание трицепса плеча вследствие снижения мышечного тонуса на фоне андрогенного дефицита.
Рис. 4. Нависание трицепса, вертикальное положение (характерная складка над локтем).
Рис. 5. Нависание передней группы мышц бедра над коленной чашечкой вследствие снижения мышечного тонуса на фоне андрогенного дефицита.
Характерно также снижение либидо вплоть от отвращения к сексу, нарушения мочеиспускания, депрессии.
Рис. 6. Пациентка 3-го типа: отмечаются умеренная прибавку массы тела, гипотония мышц спины.
Возможности терапии
Учитывая разные типы течения климактерия и разные жалобы, пациенткам должна проводиться заместительная гормональная терапия (ЗГТ) с учетом данных особенностей.
Так, пациентки с клинически и лабораторно подтвержденным дефицитом андрогенов не должны получать препарат ЗГТ с антиандрогенными свойствами, в связи с тем что ряд жалоб (ожирение, снижение либидо, мышечная гипотония, ноктурия и др), обусловленных дефицитом андрогенов, могут только усугубиться.
В то же время при сохраненной секреции андроге-нов назначение препаратов с андрогенной активностью может привести к нежелательным явлениям андрогенизации: рост волос на лице, повышенная сальность кожи, чрезмерно повышенное либидо, прибавка мышечной массы.
Главная роль в лечении климактерических расстройств принадлежит эстрогенному компоненту, однако особенности гестагена, входящего в состав комбинированного препарата ЗГТ, также могут определять его дополнительные лечебные или потенциально негативные свойства [26].
Поэтому при отсутствии специальных показаний при выборе ЗГТ предпочтителен гестаген, обладающий высоким сродством к прогестероновым рецепторам для полноценной защиты эндометрия и при этом «нейтральный» в отношении других типов рецепторов, в том числе и андрогеновых.
Различия в сродстве гестагенов к тем или иным типам стероидных рецепторов представлены в табл.2.
Табл. 2 Относительное сродство прогестагенов к стероидным рецепторам [27]
Относительное сродство прогестагенов [% связывания стероидов]
Прогестероновые рецепторы
Андрогеновые рецепторы
Эстрогеновые рецепторы
Глюкокортикоидные рецепторы
Минералокорти-коидные рецепторы
Секс-стероид связывающий глобуллин (СССГ)
Adolf E. Schindler, Progestational effects of dydrogesterone in vitro, in vivo and on the human endometrium
Влияние заместительной эстроген-гестагенной и андрогензаместительной терапии на метаболические показатели у женщин в перименопаузе.
Метаболический синдром и СД являются главными факторами риска для развития сердечно-сосудистых осложнений, особенно в сочетании с артериальной ги-пертензией. Частота СД увеличивается с возрастом и менопаузой. Дефицит эстрогенов, возникающий в пе-рименопаузе в сочетании с абдоминальным ожирением и инсулинорезистентностью, является одним из факторов риска развития СД у женщин. В 2006 г. в мета-анализе, основанном на 107 исследованиях, было показано, что ЗГТ способствует уменьшению выраженности абдоминального ожирения, инсулинорезистентности, благоприятно влияет на липидный профиль и снижает число эпизодов впервые выявленного СД [12].
У относительно здоровых женщин в постменопаузе ни пероральный, ни трансдермальный эстрадиол существенно не влияли на уровень глюкозы. Однако было отмечено разное действие конъюгированных эквинных эстрогенов и эстрадиола (перорального и трансдермального) на чувствительность к инсулину: в то время как при назначении эстрадиола отмечалось увеличение чувствительности, конъюгирован-ные эквинные эстрогены, наоборот, ее уменьшали [13]. Прогестины оказывают влияние на углеводный обмен и инсулинорезистентность, однако их влияние зависит как от способа введения прогестина, так и от его типа. Такие прогестины, как медроксипроге-стерона ацетат (МПА) и норэтистерона ацетат, могут негативно влиять на углеводный обмен и усугублять инсулинорезистентность. Напротив, прогестерон и дидрогестерон не оказывают негативного влияния [13], поэтому назначение препаратов, в состав которых входит дидрогестерон (Фемостон®) является предпочтительным для женщин, у которых климактерические симптомы протекают на фоне ожирения, инсулинорезистентности, метаболического синдрома и СД, а также для тех, кому показана длительная ЗГТ.
Также в двойном слепом плацебо-контролируемом исследовании было показано, что назначение транс-дермального пластыря с тестостероном женщинам с андрогенной недостаточностью, вызванной гипопи-туитаризмом, приводило к улучшению чувствительности к инсулину [14].
Половые гормоны и функция эндотелия
Применение андрогенов у женщин показало положительное вазодилатирующее влияние. Так, S.Worboys и соавт. исследовали эффекты парентеральной терапии тестостероном у женщин, получающих ЗГТ. Было обследовано 33 женщины в постменопаузе, получающие ЗГТ более 6 мес в сочетании имплантами с тестостероном (50 мг). Контрольную группу составили 15 женщин, не получающих никакой терапии. При помощи ультразвукового исследования обследовались диаметр плечевой артерии, реактивная гиперемия (эн-дотелийзависимая вазодилатация) и действие нитроглицерина (эндотелийнезависимая вазодилатация). В основной группе отмечалось повышение уровней тестостерона, что ассоциировалось с увеличением на 42% эндотелийзависимой вазодилатации. В контрольной группе не было отмечено никаких изменений. Похожие данные были получены в отношении эндотелийнезави-симой вазодилатации. Авторы пришли к выводу, что парентеральная терапия тестостероном у женщин с дефицитом андрогенов в постменопаузе, длительно получающих ЗГТ, улучшает как эндотелийзависимую, так и эндотелийнезависимую вазодилатацию плечевой артерии [25].
Заключение
На сегодняшний день имеются данные, что андрогены у женщин могут оказывать положительное влияние на разные органы и системы, однако отсутствие в нашей стране сертифицированных для женщин препаратов тестостерона не позволяет широко применять их в гинекологической практике. Вместе с тем при выборе эстроген-гестагенных препаратов для ЗГТ необходимо учитывать индивидуальные особенности каждой пациентки. Препараты, содержащие дидрогестерон (Фемостон® 2/10, Фемостон® 1/10, Фемостон® 1/5 копти), обладают нейтральным эффектом в отношении андрогенного статуса женщины, не оказывая ни андрогенного, ни антиандро-генного действия, и не способны усугублять симптомы, вызванные снижением уровня тестостерона у пациенток, у которых менопауза протекает с дефицитом и эстрогенов, и андрогенов.
Статья подготовлена при поддержке компании Abbott. 2012/08-166
ПРЕЖДЕВРЕМЕННАЯ МЕНОПАУЗА
Термин «менопауза» образован от греческих «менос» (месяц) и «паузос» (окончание) и означает стойкое прекращение менструации или менструальных циклов, обусловленное выраженным снижением и/или прекращением (выключением) функции яичников. В зависимости
Термин «менопауза» образован от греческих «менос» (месяц) и «паузос» (окончание) и означает стойкое прекращение менструации или менструальных циклов, обусловленное выраженным снижением и/или прекращением (выключением) функции яичников.
В зависимости от времени наступления различают следующие типы менопаузы:
Как преждевременная, так и поздняя менопауза требуют пристального внимания и коррекции возможных нарушений. Ввиду того что всегда трудно оценить, какая менструация была последней, принято оценивать дату менопаузы ретроспективно, а именно: спустя один год после последней менструации.
Возраст менопаузы чаще зависит от наследственности, что убедительно показано на однояйцовых близнецах, когда разница возраста первой и последней менструации у близнецов колеблется в пределах 4-6 мес. Однако важную роль играют болезни, перенесенные данным индивидуумом, и факторы окружающей среды.
Преждевременная менопауза довольно редкое явление (1-2%), однако причин ее возникновения существует множество. Нередко истинную причину установить довольно трудно.
Яичник представляет собой сложную структуру, в рамках которой различают корковый и мозговой слои. В коре яичника внутриутробно закладываются яйцеклетки, окруженные гранулезными клетками, формируя фолликулы с яйцеклетками. К моменту первой менструации в пубертатном периоде в яичниках обнаруживается 300-400 тыс. этих фолликулов. В течение 25-30 лет репродуктивного периода в яичниках постоянно происходит созревание фолликулов, овуляция и гибель (атрезия) фолликулов посредством апоптоза. Лишь 0,1% от числа фолликулов овулирует и может давать жизнь потомству, а 99,9% атрезируется. К возрасту 40 лет остается в среднем около 10 тыс. фолликулов. Кроме того, в яичниках синтезируются как женские (эстрогены и прогестерон), так и, в меньшей степени, мужские половые гормоны. Эти гормоны участвуют в формировании типично женского телосложения и ежемесячно готовят репродуктивные органы к беременности.
Рецепторы к эстрогенам и прогестерону выявлены не только в репродуктивных органах. Гормональные рецепторы (представительства), через которые оказывают свое воздействие половые гормоны, обнаружены в сердце и стенках сосудов, в ЦНС, костной, мочеполовой и других органах и системах организма. Поскольку у молодой женщины половые гормоны выделяются в циклическом режиме, то соответственно органы и ткани испытывают на себе их воздействие также в циклическом режиме.
При преждевременной менопаузе соответственно прекращается циклическое выделение и влияние женских половых гормонов на различные органы и ткани, которые в течение десятилетий испытывали на себе это воздействие. Кроме того, женщина утрачивает и способность к зачатию.
В последние годы все большее распространение получает мнение, что может быть целесообразнее это состояние называть не «преждевременной менопаузой», а «преждевременной недостаточностью яичников». Хотя, по сути, речь идет об одном и том же процессе, но с точки зрения деонтологии терминологически и врачу, и пациенту целесообразнее называть это состояние «преждевременной недостаточностью яичников».
Основные причины преждевременной недостаточности яичников:
Согласно нашей практике преждевременная яичниковая недостаточность отмечается нередко у матери и дочери. Несмотря на то что причин много, но процессы в яичниках в основном происходят по двум основным сценариям:
Клиническая картина
Общее при обоих вариантах:
Основные различия двух форм преждевременной недостаточности яичников заключаются в следующем.
При истощении фолликулярного аппарата:
при резистентности яичников:
При истощении яичников симптомы эстроген-дефицита или симптомы типичного климактерического синдрома более выражены.
При синдроме резистентных яичников менее выражены эстроген-дефицитные симптомы, так как возможны, хотя и проявляются крайне редко, активация функции яичников и, соответственно, улучшение общего состояния.
Тактика ведения больных с преждевременной недостаточностью яичников
Поскольку менопауза преждевременная, а в этом возрасте в норме яичники функционируют, следовательно, преждевременный дефицит половых гормонов может способствовать более раннему появлению типичных климактерических расстройств, частота которых составляет 60-70%.
Классификация климактерических расстройств
Вазомоторные: приливы жара, ознобы, повышенная потливость, головные боли, гипотония или гипертензия, учащенное сердцебиение.
Эмоционально-вегетативные: раздражительность, сонливость, слабость, беспокойство, депрессия, забывчивость, невнимательность, снижение либидо.
Урогенитальные: сухость во влагалище, боль при половом сношении, зуд и жжение, уретральный синдром, цисталгии, недержание мочи.
Кожа и ее придатки: сухость, ломкость ногтей, морщины, выпадение волос.
Сердечно-сосудистые заболевания (ИБС, атеросклероз), постменопаузальный остеопороз или остеопения.
Индивидуальный подбор терапии
Принимая во внимание вышесказанное, представляется важным выработать на долгосрочную перспективу индивидуальную «программу восстановления и сохранения здоровья» с учетом семейного и личного риска основных болезней старения. Такая программа должна включать регулярное обследование, а именно УЗИ, маммографию, денситометрию и/или определение биохимических маркеров костного ремоделирования, липидограмму, онкомаркеры и т. д., а также рекомендации по изменению образа жизни, поскольку повышение двигательной активности, сбалансированная диета, отказ от курения и других вредных привычек способствуют снижению риска сердечно-сосудистых заболеваний и остеопороза.
В последние годы ведется постоянный поиск и совершенствование терапевтических подходов к рациональному использованию ЗГТ у каждой конкретной пациентки (индивидуализация терапии). Препараты для ЗГТ отличаются друг от друга только своим прогестагенным компонентом, так как эстрогенный компонент представлен 17β-эстрадиолом или эстрадиола валератом, которые по структуре соответствуют яичниковому эстрадиолу. Кроме того, в последнее время большое внимание уделяется выбору пути введения препарата (оральный или трансдермальный).
Подбор типа гормонотерапии проводится также с учетом следующих факторов:
Основные принципы и показания для назначения ЗГТ
Необходимо предоставлять женщинам соответствующую информацию, которая позволяла бы им принимать осознанное решение на проведение ЗГТ. Все женщины должны быть проинформированы:
Для обеспечения оптимального клинического эффекта с минимальными побочными реакциями крайне важно определить наиболее приемлемые оптимальные дозы, типы и пути введения гормональных препаратов.
Существуют три основных режима ЗГТ.
Режим 2 и 3 назначается женщинам с интактной маткой.
Монотерапия эстрогенами: прерывистые курсы (эстрофем, прогинова, эстримакс, дивигель, эстрожель, пластырь климара, овестин) или непрерывный режим по 3-4 нед с недельными перерывами.
Комбинированная терапия (эстрогены с прогестагенами) в циклическом режиме:
При этом режиме наблюдается менструальноподобная реакция, что крайне важно в психологическом плане для молодой женщины.
Монофазная комбинированная терапия (эстрогены с прогестагенами) в непрерывном режиме (клиогест, климодиен, паузогест).
При непрерывном режиме гормонотерапии менструальноподобная реакция исключается.
Ливиал (тиболон) в непрерывном режиме обладает эстрогенной, прогестагенной и слабой андрогенной активностью.
Если гистерэктомия произведена по поводу генитального эндометриоза, предпочтение отдается монофазной комбинированной терапии (климодиен, клиогест, паузогест) или ливиалу с целью исключения стимуляции возможных эндометриоидных гетеротопий монотерапией эстрогенами.
Если в клинической картине доминируют изменения в сердечно-сосудистой системе и атерогенные фракции липидов в крови, предпочтение следует отдавать двух- или трехфазным препаратам, в которых гестагенный компонент представлен производными прогестерона (климен, фемостон).
При урогенитальных расстройствах в перименопаузе предпочтение отдается местной (вагинальной) монотерапии эстриолом без добавления прогестагенов. При сочетании урогенитальных расстройств с системными обменными нарушениями (остеопороз, атеросклероз) возможно сочетание местной и системной терапии.
Циклическая двух- и трехфазная ЗГТ наряду с улучшением общего состояния способствует регуляции менструального «цикла», а также профилактике гиперпластических процессов в эндометрии благодаря циклическому добавлению прогестагенов. Крайне важно информировать женщину о следующем:
Итак, комбинированные двух- и трехфазные препараты наиболее приемлемы для женщин с преждевременной менопаузой, так как обеспечивают циклическую защиту эндометрия прогестагенами, подобно тому, как это происходит в нормальном менструальном цикле.
При тяжелых заболеваниях печени, поджелудочной железы, мигренях, артериальном давлении более 170 мм рт. ст., тромбофлебитах в анамнезе показано парентеральное назначение эстрогенов в виде еженедельного пластыря (климара) или геля (дивигель, эстражель). В подобных случаях при интактной матке обязательно добавление прогестерона и его аналогов (дюфастон, утрожестан).
Рекомендуется следующее обследование перед назначением ЗГТ:
Противопоказания для назначения ЗГТ:
При противопоказаниях к ЗГТ решается вопрос об использовании альтернативной терапии: фитоэстрогены (климадинон) или гомеопатические средства (климактоплан).
Гормонотерапию следует продолжать до возраста естественной менопаузы (50-55 лет); в дальнейшем вопрос решается индивидуально с учетом желания женщины, состояния ее здоровья, реакции на гормональные препараты.
В. П. Сметник, доктор медицинских наук, профессор
ГУ Научный центр акушерства, гинекологии и перинатологии РАМН, Москва
Роль гестагенов в заместительной гормональной терапии. Нужны ли гестагены при хирургической менопаузе?

В статье представлены данные литературы и точка зрения авторов по важной медико-социальной проблеме — болезням молочных желез, занимающим ведущее место в заболеваемости женщин. Эти болезни крайне многообразны, они не только нарушают трудоспособность женщи
The article reviews the literature and present the author’s opinion on important medical and social problem – diseases of mammary glands that are the major type of women illness. These diseases are manifold and do not only hamper work ability of women but affect their reproductive functions. The article provides the details of the variants of effective pathogenetic therapy of mastopathies and results of clinical trials. It also gives recommendations to application of unified gynaecological and mammalogy screening as the base of prophylaxis, diagnostics and treatment of mammary glands diseases.
Заместительная гормональная терапия (ЗГТ) является эффективным средством коррекции климактерических нарушений, которые традиционно ассоциируются с вазомоторными симптомами (приливы жара, потливость), нарушениями сна, изменением настроения, метаболическими нарушениями (менопаузальный метаболический синдром), нарушением сексуальной функции и урогенитальными атрофическими изменениями. Кроме того, своевременное назначение ЗГТ является эффективной мерой профилактики постменопаузального остеопороза. Согласно современным представлениям, термин ЗГТ используется для обозначения терапии, включающей эстрогены, гестагены, комбинированную эстроген-гестагенную терапию, андрогены и тиболон [1].
Несмотря на высокую эффективность, широкому применению ЗГТ у женщин в пери- и постменопаузе препятствует ряд стереотипов, мифов и противоречивых данных, связанных с безопасностью такой терапии. В частности, недостаточно изучены вопросы влияния различных типов ЗГТ на молочные железы и сердечно-сосудистую систему. Как правило, ЗГТ назначается сроком не более 5 лет [2]. Это связано с тем, что ряд исследований показал повышение риска развития рака молочной железы при использовании эстроген-гестагенной ЗГТ свыше 5 лет за счет негативного действия гестагенного компонента на молочные железы. Кроме того, у женщин с хирургической менопаузой рекомендуется применять монотерапию эстрогенами для снижения риска развития рака молочной железы, в то время как считается, что гестагены нужны только женщинам с сохраненной маткой для профилактики гиперпластических процессов в эндометрии [3].
В последние годы во многих странах отношение к назначению ЗГТ становится более либеральным, что нашло свое отражение в ряде руководств по постменопаузальной ЗГТ [1, 3, 4], в то время как в России по-прежнему остаются сильны старые стереотипы о том, что ЗГТ при длительном применении значительно повышает риск развития рака молочной железы, инфарктов, инсультов, а также о том, что ЗГТ нельзя назначать пожизненно. Краеугольным камнем и постоянным поводом для дебатов является роль гестагенного компонента в ЗГТ, которая, на наш взгляд, часто остается недооцененной. Гестагены являются синтезированными производными прогестерона — одного из ключевых гормонов, необходимого не только для реализации репродуктивной функции у женщин, но и для поддержания метаболизма.
Роль прогестерона у женщин
Как следует из его названия (лат. pro — для, gestation — беременность), прогестерон — ключевой гормон, необходимый для подготовки к беременности (секреторная трансформация эндометрия) и ее вынашивания (токолитическое действие).
Помимо влияния на матку, прогестерон оказывает действие и на молочные железы, вызывая рост альвеол, долек и приводя к развитию в них железистой трансформации. На протяжении нормального менструального цикла митотическая активность эпителия молочных желез невелика в фолликулярной фазе и достигает максимума в лютеиновой фазе менструального цикла, что связывают с митогенным действием прогестерона. Это действие, однако, непродолжительно, и постоянное присутствие гормона быстро прекращает пролиферацию эпителия [5]. В то же время пролиферация эндометрия максимальна в фолликулярной фазе (благодаря высокой концентрации эстрогенов), а в лютеиновой фазе под действием прогестерона она уменьшается. В зависимости от дозы и продолжительности воздействия прогестерон потенциально может видоизменять ответ как нормальных, так и раковых клеток молочной железы на разных уровнях: посредством стимуляции продукции 17-бета-гидроксистероиддегидрогеназы и эстронсульфотрансферазы, которые быстро окисляют эстрадиол в менее активный эстрон и затем, связывая последний, превращают его в неактивный эстрона сульфат; созревания и дифференцировки эпителия альвеол, который подвергается дальнейшему клеточному делению; down-регуляции эстрогенных рецепторов в эпителии молочных желез, что проявляется снижением пролиферации клеток, стимулированной эстрогенами; модуляции апоптоза клеток модулирования митогенных протоонкогенов.
Таким образом, наряду со снижением экспрессии рецепторов эстрогенов, прогестерон уменьшает локальный уровень активных эстрогенов, ограничивая тем самым стимуляцию пролиферации тканей молочной железы.
Однако было бы ошибочно полагать, что прогестерон оказывает влияние только на ткани и органы репродуктивной системы.
Влияние прогестерона на жировой и углеводный обмен
Прогестерон оказывает важное влияние на показатели углеводного, липидного и белкового обмена. Этот гормон вызывает гиперинсулинемию, возможно, путем прямого действия на бета-клетки поджелудочной железы, а также увеличивает запасы гликогена в печени. При этом он противодействует эффектам инсулина в метаболизме глюкозы в мышечной ткани, вызывая инсулинорезистентность. Прогестерон способствует повышению липопротеидов низкой плотности (ЛПНП) и снижению липопротеидов высокой плотности (ЛПВП). Прогестерон стимулирует отложение жира в организме и оказывает катаболические эффекты на белковый обмен. Все эти биологические эффекты прогестерона определяют физиологические изменения, наблюдаемые во время нормальной беременности [6].
Так, инсулинорезистентность является физиологичным состоянием для беременной женщины и необходима для защиты матери от гипогликемии, так как плод получает глюкозу из материнской крови. ЛПНП являются источником для построения клеточных мембран, соответственно, их повышение необходимо для роста и развития плода. Увеличение жировой массы во время беременности под действием постоянно возрастающей секреции прогестерона является своеобразным энергетическим депо. В то же время инсулинорезистентность, повышение ЛПНП, снижение ЛПВП, увеличение жировой массы (особенно висцерального жира) являются основными факторами риска сердечно-сосудистых заболеваний [1].
Исходя из этого, препараты прогестерона при превышении физиологических концентраций у небеременных женщин могут оказывать негативное влияние на жировой, углеводный и липидный обмен, и чем выше активность препарата (что имеет место у синтетических гестагенов), тем значительнее будут выражены эти негативные побочные эффекты.
Влияние прогестерона на центральную нервную систему
Известно, что наряду с хорошо изученным репродуктивными и эндокринными эффектами, прогестерон играет важную роль в регуляции пластических процессов в головном и спинном мозге, периферической нервной системе. Установлено, что он синтезируется в нейронах и глиальных клетках центральной и периферической нервной системы в приблизительно равных концентрациях у мужчин и женщин [7]. Центральные механизмы действия прогестерона в центральной нервной системе (ЦНС) полностью не изучены.
Прогестерон и синтетические гестагены способны стимулировать синтез и высвобождение нейромедиаторов и нейропептидов в ответ на определенные физиологические и патологические раздражители. Эти эффекты реализуются путем активации рецептора прогестерона или набора внутриклеточных путей его действия. Отличные друг от друга эффекты различных гестагенов на ЦНС определяются количеством нейроактивных метаболитов прогестерона, таких как 3- и 5-альфа-аллопрегнанолон. Аллопрегнанолон влияет на возбудимость нейронов и глии путем прямой активации рецепторов гамма-аминомасляной кислоты (ГАМК)-A, оказывает седативное, анксиолитическое, обезболивающее и противосудорожное действие [8]. Эстрогены повышают в ЦНС и сывороточные уровни аллопрегнанолона, и назначение некоторых синтетических прогестинов может приводить к дальнейшему увеличению уровней аллопрегнанолона в случае, если химическая структура молекулы прогестина приближена к натуральному прогестерону. Натуральный прогестерон и синтетические гестагены могут оказывать различные биологические эффекты в ЦНС [9]. В одном исследовании было показано, что введение энантиомера (зеркального изомера) прогестерона уменьшало отек мозга, гибель нейронов, воспалительные цитокины и реактивный глиоз [10].
Влияние прогестерона на сердечно-сосудистую систему
В исследовании с использованием видеомикроскопической записи кровотока, морфологии кровеносных сосудов, а также деятельности различных клеток крови животных, назначение прогестерона не привело к сосудистой токсичности [11]. Кроме того, в других исследованиях прогестерон и дидрогестерон не противодействовали вазодилатации, вызываемой эстрогенами [12–14]. Тем не менее, были некоторые опасения, связанные с применением высоких доз прогестерона [15, 16]. Некоторые авторы считают, что применение прогестерона может усугублять сердечно-сосудистые воспалительные реакции [17]. В других же исследованиях было продемонстрировано благотворное влияние прогестерона в экспериментально вызванной ишемии головного мозга, где вазоконстрикция является ключевым патологическим процессом [18].
В отличие от натурального прогестерона, применение синтетических прогестинов, таких как медроксипрогестерона ацетат (МПА), показало их сосудистую токсичность [11]. Было показано, что синтетические прогестины вызывали разрушение эндотелия в периферических сосудах и сосудах головного мозга, накопление моноцитов в стенке сосуда, а также активацию тромбоцитов [11]. Подобные эффекты, демонстрирующие негативные последствия МПА на сосудистую систему, были описаны и в других исследованиях [19, 20]. В то же время прогестерон и дидрогестерон увеличивали синтез оксида азота эндотелиальными клетками человека, что не было описано при применении синтетических гестагенов [13, 14].
Влияние прогестерона на нижние мочевые пути
Менопаузальный цистит относится к средневременным последствиям менопаузы. Частота данной патологии по различным данным составляет 30–40% от общего количества урологических больных женщин и наблюдается преимущественно у пациенток от 45 лет и выше, с тенденцией к увеличению в поздний постменопаузальный период, когда угасание гормональной функции достигает своего апогея. В развитии заболевания ведущая роль, в частности, принадлежит дисфункции яичников, сопровождающейся недостатком половых гормонов. Бактериальная обсемененность мочевого пузыря является только предпосылкой к воспалению, реализация же его происходит при нарушении структуры и функции мочевого пузыря. Контроль за эпителиальной проницаемостью в мочевом пузыре традиционно считают результатом уникального строения эпителия, который представляет ионную помпу благодаря наличию специальных соединений между клетками. В то же время известно, что изнутри уротелий покрыт тонким защитным слоем протеогликанов или глико-замзиногликанов (ГАГ), с помощью которого может создаваться и поддерживаться барьер между стенкой мочевого пузыря и мочой, так называемый барьер «кровь–моча». Поверхностные протеогликаны или муцин выполняют в мочевом пузыре различные защитные функции, включая антиадгезивную, и регулируют трансэпителиальное движение растворов. Переходные клетки наружной поверхности ГАГ-слоя способны предотвращать адгезию бактерий, кристаллов, протеинов и ионов. В защитной системе слизистой оболочки мочевого пузыря важная роль отводится гликопротеину, который покрывает слизистую мочевого пузыря, тем самым защищая подлежащие ткани мочевого пузыря от воздействия мочи как агрессивного химического фактора, и выполняет антисептическую функцию. Гликокаликс вырабатывается переходным эпителием. Обволакивая микроорганизмы, попавшие в мочевой пузырь, он элиминирует их. Образование мукополисахаридного слоя (муцина) у женщин является в основном гормонально зависимым процессом, где эстрогены влияют на его синтез, а прогестерон — на выделение его эпителиальными клетками [21].
Влияние прогестерона на костную ткань
Хорошо известно, что костная ткань является мишенью для половых гормонов. Наиболее хорошо изучены эффекты эстрогенов на костную ткань. Кроме того, было показано, что, помимо эстрогенов, андрогены также оказывают действие на костный метаболизм [22, 23]. В 1990 г. были получены экспериментальные, эпидемиологические и клинические данные, подтверждающие важную роль прогестерона в метаболизме костной ткани [24]. Автор предложил, что прогестерон может играть определенную роль в балансе резорбции кости и образовании костной ткани, при том что основное действие эстрогенов — подавление резорбции, а основной эффект прогестерона — формирование костной ткани. Прогестерон может стимулировать образование костной ткани непосредственно путем регуляции экспрессии генов-мишеней, а также косвенным путем, противодействуя влиянию глюкокортикоидов, которые, как известно, подавляют образование костной ткани [24–26].
С момента публикации J. C. Prior [24], публикации, относящиеся к эффектам прогестерона и прогестинов на метаболизм костной ткани, остаются относительно редкими, и их значение в физиологии костного ремоделирования еще недостаточно изучено. Это объясняется несколькими фактами: 1) в ЗГТ используются различные виды прогестинов с разными фармакологическими свойствами и не всегда ясно, могут ли эффекты ЗГТ быть отнесены к действию на прогестероновые рецепторы или этот эффект реализуется через с другие стероидные рецепторы; 2) положительный эффект прогестерона и прогестинов может быть замаскирован одновременным использованием эстрогенов, витамина D и кальция [27, 28]; 3) прогестагены могут действовать в синергии с эстрогенами и не имеют никакого влияния на прогестероновые рецепторы (ПР). В одном клиническом исследовании сочетание низкой дозы этинилэстрадиола с норэтистерона ацетатом оказывало больший остеопротективный эффект, чем монотерапия эстрогенами [29].
Что касается действия непосредственно прогестерона, внутриклеточные ПР присутствуют в культурах остеобластов и остеокластов человека [30–32]. Существует также доказательство того, что прогестерон может воздействовать на костные клетки совместно с эстрадиолом и тем самым усиливать свои эффекты. Таким образом, в культуре остеобластов человека эстрадиол, как было показано, увеличивает удельную связь прогестерона с его ядерными рецепторами [33].
Заключение
На наш взгляд, роль гестагенного компонента в ЗГТ по-прежнему остается недооцененной. Как правило, применение гестагенов в составе ЗГТ обосновывается только защитой эндометрия от пролиферативных эффектов эстрадиола и считается, что назначение гестаген-содержащих препаратов нежелательно женщинам с хирургической менопаузой ввиду возможного повышения риска рака молочной железы. В то же время в исследованиях, показавших, что гестагены могут способствовать увеличению риска развития рака молочной железы при длительном применении, использовались синтетические препараты, такие как МПА и норэтистерона ацетат, действительно повышающие этот риск. В противоположность этому применение натурального прогестерона и максимально приближенного к нему дидрогестерона достоверно не увеличивало риск развития рака молочной железы [34, 35]. Кроме того, в пользу применения гестагенов в составе ЗГТ говорит тот факт, что совместное применение эстрогенов и гестагенов, в отличие от монотерапии эстрогенами, снижает риск возникновения рака печени, рака желчного пузыря и колоректального рака приблизительно на 40% [36, 37].
Мы считаем, что в ЗГТ должны применяться только препараты, максимально приближенные к тем гормонам, которые вырабатываются в организме женщины, а все значимые побочные эффекты (как метаболические, так и онкологические риски) обусловлены только синтетическими составляющими гестагенного компонента ЗГТ.
Литература
ФГБОУ ВПО РУДН, Москва