Лимфоидные фолликулы желудка что такое
Лимфоидные фолликулы желудка что такое
Имеется вариабельность в строении лимфатических узлов из различных анатомических областей. Для лимфатических узлов шеи характерна типичная структура фолликулов, паракортикальной зоны, мозгового вещества и синусов. Подмышечные лимфатические узлы в состоянии покоя имеют вид ободка лимфоидной ткани вокруг жировой ткани в центре.
При злокачественных лимфомах и других лимфопролиферативных состояниях эта жировая ткань заселяется опухолевыми клетками и может полностью исчезнуть. Брыжеечные лимфатические узлы имеют более широкие синусы и обычно менее заметные фолликулы и паракортикальную зону.
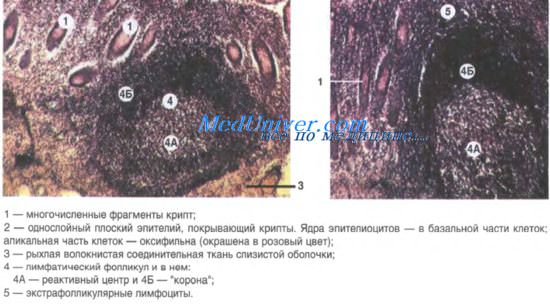
Лимфоидные фолликулы отвечают за Т-зависимое образование антител. Они являются местом образования различных антител и переключения изотипов. Первичные фолликулы построены из малых В-клеток, несущих на поверхности IgM и IgD, и фолликулярных дендритных клеток. Если рассечь вторичный фолликул в области полюса, не затрагивая центр размножения, он будет выглядеть как первичный фолликул.
Вторичные фолликулы имеют центр размножения, состоящий из бластных клеток (центробласты) и их потомства (центроциты). Эти клетки проявляют полярность, выражающуюся в формировании темной зоны из бластных клеток (из-за выраженной базофилии цитоплазмы при окрашивании по Гимза) и светлой зоны из центроцитов. В клетках темной зоны выявляются многочисленные митозы и высокая степень пролиферации; во многих клетках могут определяться признаки апоптоза.
Обычно полярность фолликулов лучше видна в лимфоидных фолликулах слизистых оболочек (таких как слизистая миндалины) и лимфатических узлах.
В-клетки центра размножения не экспрессируют BCL-2 и, таким образом, подвержены апоптозу. Допускается, что только В-клетки, обеспечивающие хорошую аффинность антител, реэкспрессируют BCL-2 и выживают. Апоптозу подвергается значительная доля В-клеток фолликулярных центров, которые захватываются макрофагами центра (макрофаги «окрашенных телец»).
Центр размножения окружен мантийной зоной, состоящей из малых В-лимфоцитов с фенотипом, похожим на таковой клеток, обнаруживаемых в первичных фолликулах. В-клетки маргинальной зоны со светлой цитоплазмой могут обнаруживаться кнаружи от мантийной зоны. Часто такие клетки обнаруживаются в брыжеечных узлах, но обычно не заметны в других местах. Лимфоидные фолликулы содержат сеть фолликулярных дендритных клеток (ФДК).
ФДК захватывают и удерживают иммунные комплексы на своей поверхности для презентации В- и Т-клеткам. ФДК имеют характерные ядра: часто они двуядерные или многоядерные. Рутинными методами окраски дендритные отростки не идентифицируются, но часто они хорошо визуализируются в срезах, окрашенных на IgM, маркирующий иммунные комплексы на поверхности отростков. Эти отростки также выявляются окрашиванием на CD21 и CD23.
Центры размножения с обратным развитием часто содержат интерстициальное эозино-фильное протеиногеннос вещество. Иногда в центрах роста реактивных лимфатических узлов обнаруживаются плазматические клетки. Лимфоидные фолликулы содержат различное число малых Т-клеток, многие из которых экспрессируют CD3, CD4 и CD57.
Нодулярная лимфоидная гиперплазия (НЛГ)
Нодулярная лимфоидная гиперплазия (НЛГ) ― довольно редкое доброкачественное заболевание, характеризующееся множественными узелками в слизистой оболочке различных отделов желудочно-кишечной трубки: тонкой и толстой кишки, а также желудка.
Распространенность этого заболевания до конца неизвестна, оно достаточно часто встречается у детей до 10 лет, однако иногда может наблюдаться и у взрослых лиц.
Классификация НЛГ
Выделяют две формы заболевания:
1) Фокальная НЛГ ― представлена отдельными очагами, локализованными чаще всего в терминальном отделе подвздошной кишки, прямой кишке и других участках желудочно-кишечного тракта
2) Диффузная НЛГ ― для этой формы характерно вовлечение больших участков желудочно-кишечной трубки (например, вся тонкая кишка).
Этиопатогенез НЛГ
Патогенетические механизмы развития НЛГ до сих пор остаются неясными. Однако существуют несколько теорий, которые отличаются друг от друга в зависимости от того, имеется ли у пациента ассоциированное иммунодефицитное состояние или нет.
Так, если у пациента подтвержден иммунодефицит, то образование узелков в слизистой оболочке может быть результатом скопления предшественников плазматических клеток (неспособных к полноценному созреванию В-лимфоцитов).
НЛГ при отсутствии нарушений иммунодефицита может быть связана с иммунной стимуляцией лимфоидной ткани кишечника. Эта гипотеза предполагает наличие постоянных раздражителей (триггеров) в просвете желудочно-кишечной трубки, чаще всего инфекционного происхождения. Повторяющаяся стимуляция иммунных клеток может привести к возможной гиперплазии лимфоидных фолликулов. Такой механизм может объяснить нередкую ассоциацию лямблиоза и Helicobacter pylori с НЛГ (см.ниже).
Клинические проявления НЛГ
Зачастую НЛГ не имеет никаких симптомов и является случайной находкой во время эндоскопического исследования желудка, толстой и тонкой кишки. Однако некоторые исследователи связывают НЛГ с желудочно-кишечными симптомами, такими как хроническая диарея, боль в животе, желудочно-кишечное кровотечение (оккультное или явное, из прямой кишки) и кишечная непроходимость (очень редко). У части пациентов может отмечаться потеря белка и снижение массы тела.
Насколько велик вклад НЛГ в возникновение симптомов, до сих пор остается неясным. Является ли это состояние первопричиной жалоб или НЛГ ― всего лишь случайная находка у пациента с желудочно-кишечной симптоматикой? Вопросов больше, чем ответов.
Ассоциированные с НЛГ заболевания и состояния
Достаточно часто по сравнению с другими лицами НЛГ выявляется у пациентов с иммунодефицитами. Так, 20% больных, страдающих общим вариабельным иммунодефицитом (ОВИД), имеют НЛГ. ОВИД ― заболевание, характеризующееся снижением уровней иммуноглобулинов различных субклассов (G, A, M), нарушенным иммунным ответом из-за снижения выработки антител. Пациенты часто страдают рецидивирующими бактериальными инфекциями дыхательных путей, аутоиммунными заболеваниями и имеют повышенный риск развития онкологических патологий. НЛГ при ОВИД обычно генерализованная, с вовлечением всей тонкой кишки.
НЛГ нередко ассоциирована с селективным дефицитом IgA, который выявляется у 1 из 300-700 лиц европеоидной расы. У таких людей отмечается снижение уровня IgA в крови ниже 0,7 г/л при нормальных или даже повышенных уровнях других иммуноглобулинов. Большинство лиц с селективным дефицитом IgA бессимптомны, однако у части из них встречаются рецидивирующие инфекции верхних дыхательных путей, аутоиммунные заболевания, аллергии и желудочно-кишечные патологии (целиакия, НЛГ).
НЛГ может быть ассоциирована с лямблиозом как у лиц с нормальным иммунным ответом, так и с иммунодефицитом. Триада НЛГ + лямблиоз + снижение уровня гамма-глобулинов известна как синдром Германа (англ. Herman’s syndrome).
Инфекция Helicobacter pylori может быть причиной развития НЛГ с вовлечением желудка и 12-перстной кишки.
НЛГ также нередко встречается у лиц с ВИЧ-инфекцией, может быть ассоциирована с семейным аденоматозом толстой кишки и синдромом Гарднера.
Существуют данные о возможной ассоциации синдрома раздраженного кишечника (СРК) с НЛГ. При этом рядом авторов НЛГ рассматривается как проявление малоактивного воспаления в слизистой оболочке толстой кишке у пациентов с СРК.
Осложнения НЛГ
НЛГ ― заболевание доброкачественное, и крайне редко приводит к развитию осложнений. Однако описаны случаи кишечной непроходимости у лиц с распространенным процессом в тонкой кишке, а также кишечных кровотечений..
Известно, что у лиц с НЛГ повышается риск лимфопролиферативных заболеваний (лимфомы), однако точный риск не установлен.
Диагностика НЛГ
Существует два основных метода диагностики НЛГ:
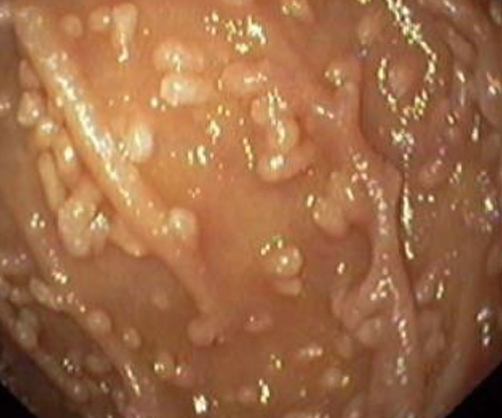
1) Эндоскопический ― выявление узелков различных размеров (2-10 мм, в среднем 5 мм) на слизистой оболочке желудка, тонкой кишки, толстой/прямой кишки. Такие узелки (чаще всего в виде выступающих папул) могут быть обнаружены при гастроскопии (ЭГДС), колоноскопии, энтероскопии или капсульной эндоскопии.
На фото ― НЛГ в 12-перстной кишке.
2) Гистологический метод ― выявление в слизистой оболочке и в поверхностной части подслизистого слоя увеличенных (гиперплазированных) лимфоидных фолликулов, которые обычно формируют группы, и могут практически сливаться между собой.
Дифференциальный диагноз
Дифференциальный диагноз ЛНГ проводится с лимфопролиферативными заболеваниями (лимфома тонкой кишки, желудка). При локализации НЛГ в толстой кишке ее элементы (узелки) могут напоминать аденоматозные полипы.
Важно помнить, что у некоторых пациентов при проведении илеоколоноскопии в подвздошной кишке могут также выявляться лимфоидные фолликулы. В этой зоне концентрация лимфоидных фолликулов максимальная по сравнению с другими отделами кишечной трубки. При этом в отличие от НЛГ узелки (те самые лимфоидные фолликулы) небольших размеров (1-3 мм, реже больше), они располагаются отдельно друг от друга, не сливаясь, между ними видны участки нормальной слизистой. Эти изменения не следует рассматривать как патологию, они ― вариант нормы.
Лечение НЛГ
Сама по себе ЛНГ не требует лечения. В случае, если имеются ассоциированные заболевания (лямблиоз, инфекция Helicobacter pylori), следует провести терапию, направленную на удалению возбудителя.
Прогноз НЛГ
Прогноз НЛГ в целом благоприятный, в большинстве случаев требуется лишь динамическое наблюдение за пациентом.
Лимфоидные фолликулы желудка что такое
Мы, однако, наблюдали и выраженные эрозивные изменения лимфоидных фолликулов, что следует отнести к стадии IV, поэтому считаем необходимым дополнить эту классификацию.
Для IV стадии характерно наличие гиперемии слизистой оболочки, эрозий, покрытых фибрином, с конгломератами воспаленных лимфоидных фолликулов, что расценивалось как проявление илеита. Складки слизистой оболочки были сглажены или несколько утолщены, исчезала поверхностная зернистость, слизистая оболочка имела матовый оттенок, сосудистый рисунок чаще был усилен. Подобные изменения слизистой оболочки никогда не локализовались только в терминальном отделе тонкой кишки, а распространялись на значительно более протяженные ее сегменты и не имели тенденции к стиханию в оральном направлении.
Таким образом, IV стадию можно расценивать как илеит на фоне лимфофолликулярной гиперплазии, но что здесь первично, что вторично, сказать трудно. Вероятно, лимфофолликулярная гиперплазия развивается первично, но по мере развития лимфоидной гиперплазии, нарастания воспаления лимфоидные фолликулы эрозируются (что соответствует нашим клиническим находкам и данным морфометрии).
В стадиях 0, I, II выраженные клинические проявления не наблюдались и лимфофолликулярная гиперплазия была случайной находкой, а в III и особенно в IV стадии в большинстве случаев отмечались боли в животе и кишечные кровотечения.
Эти данные совпадают с литературными сообщениями о том, что лимфофолликулярная гиперплазия терминального отдела подвздошной кишки у детей может быть причиной кишечного кровотечения, рецидивирующих болей в животе.
У большинства больных не отмечена взаимосвязь возникновения подобных изменений с поражениями толстой кишки. Каких-либо специфических для этой патологии симптомов выявить не удалось. У этих больных лимфофолликулярная гиперплазия была случайной находкой, хотя у большинства колоноилеоскопии проводились по поводу кишечного кровотечения. У 8 больных лимфофолликулярная гиперплазия отмечалась при терминальном илеите.
При исследовании морфометрических показателей слизистой оболочки подвздошной кишки при лимфофолликулярной гиперплазии I—II стадии не отмечалось изменений в архитектонике по сравнению с таковой в биоптатах с нормальной слизистой оболочкой. Увеличивалось число эпителиоцитов, находящихся в состоянии митоза (1,58±0,11 %; Р<0,01), число межэпителиальных лимфоцитов (МЭЛ) (до 28,9±6,1 %; Р<0,05) и клеточная плотность инфильтрата собственной пластинки. Среди клеток инфильтрата возрастало количество лимфоцитов, плазматических клеток (Р<0,05).
Вопрос о первичности или вторичности поражения лимфатического аппарата остается открытым. По-видимому, имеется взаимообусловленность и взаимосвязь между степенью воспаления слизистой оболочки и подслизистого лимфатического аппарата.
Особенности эндоскопической семиотики и антихеликобактерная терапия MALT-лимфом желудка
Лимфомы гастроинтестинального тракта охватывают от 14% до 27% всех экстранодальных поражений и составляют от 1% до 15% всех злокачественных опухолей желудочно-кишечного тракта. Чаще всего поражается желудок (50–75%), сравнительно реже тонкая кишка (20–35%
Лимфомы гастроинтестинального тракта охватывают от 14% до 27% всех экстранодальных поражений и составляют от 1% до 15% всех злокачественных опухолей желудочно-кишечного тракта. Чаще всего поражается желудок (50–75%), сравнительно реже тонкая кишка (20–35%). Лимфомы толстой кишки наблюдаются в 5–10% случаев. Самыми редкими признаны первичные неходжкинские лимфомы пищевода [1].
В 1983 году Brooks и Enterline [2] провели клинико-морфологическое исследование, где показали, что нодальные и экстранодальные лимфомы отличаются по биологическим свойствам и что экстранодальные варианты лимфомы имеют более благоприятный прогноз.
Brooks и Enterline впервые отметили патогенетическую связь между хроническим воспалением слизистой оболочки желудка и развитием лимфомы. Было высказано предположение, что многие типы лимфом желудка представляют собой злокачественную трансформацию доброкачественных и длительно текущих лимфоцитарных поражений желудка. Авторы пришли к тому заключению, что длительная антигенная стимуляция вместе с аутоиммунным феноменом в клетках слизистой оболочки желудка в целом приводят к появлению злокачественного клона. Эта гипотеза была подтверждена результатами клинико-морфологических исследований, проведенных при лимфомах слюнной и щитовидной желез. Было показано, что лимфомы этих желез могут возникнуть на фоне хронического тиреоидита и сиалоаденита с синдромом Шегрена или без него.
P. Isaacson и D. H. Wright [3] обратили внимание на то, что большая часть первичных лимфом желудка развивается на фоне хронических гастритов. Более того, было показано, что другие варианты экстранодальных лимфом также связаны с хроническими воспалительными процессами. Доказано, что Нelicobacter pylori — грамотрицательная спиралевидная бактерия, впервые выделенная из гастробиоптата австралийскими исследователями Warren и Marschall в 1983 году, является причиной подавляющего большинства случаев хронических гастритов. Она приводит к возникновению язвенной болезни желудка, 12-перстной кишки, является одним из факторов риска аденокарциномы желудка.
Показано, что при эрадикации этого микроорганизма симптомы хронического воспаления становятся менее интенсивными и снижается степень лимфоцитарной инфильтрации. В 1993 году были представлены доказательства, что Н. pylori играет важную роль в возникновении подгруппы лимфом желудка MALT-типа [4]. Рядом авторов [5] было высказано мнение, что Н. pylori вызывает нарушение физиологических и иммунологических процессов, окислительное повреждение ДНК и пролиферацию как гемапоэтических, так и клеток слизистой оболочки желудка. В дальнейшем было установлено, что 90% больных MALT-лимфомой инфицированы Н. pylori [6, 7, 8]. Было показано также, что Н. pylori непосредственно и посредством цитотокина вызывает пролиферацию Т-клеток и макрофагов, что сопряжено с высвобождением цитокинов (интерлейкина-2 и интерлейкина-6). Последние, в свою очередь, вызывают пролиферацию В-клеток, способствуют развитию лимфоидных фолликулов и агрегатов лимфоцитов в толще слизистой оболочки желудка [9].
Материалы и методы исследования
Эндоскопическая картина лимфом желудка изучена нами у 250 пациентов, при этом поражение у 160 (64%) больных расценено как первичное, а у 90 (36%) — как вторичное, наблюдаемых в РОНЦ с 1995 года, из которых было 99 пациентов с MALT-лимфомой желудка. Разработаны эндоскопические и эндосонографические критерии диагноза MALT-лимфомы, ее дифференциально-диагностические признаки, проведена оценка лекарственной терапии.
Результаты и их обсуждение
При тщательном анализе развития болезни нами установлено, что в группе с первичными лимфомами желудка практически одна треть (32%) пациентов имели гастроэнтерологический анамнез: язвенную болезнь желудка, хронический атрофический, гипертрофический или смешанные гастриты, зачастую ассоциированные с инфекцией H. pylori.
Согласно нашим наблюдениям длительность существования гастроэнтерологической патологии до установления наличия опухоли в группе с первичной лимфомой желудка весьма вариабельна: в течение первых трех месяцев диагноз установлен у 30,6% (49 больных), в течение 6 месяцев у 18,1% (29 больных), в срок от 6 до 12 месяцев у 15,6% (25 больных). Отдельно следует отметить, что практически у трети пациентов (27,5% — 44 пациента) диагноз первичной лимфомы желудка был установлен спустя год (табл. 1).
Также отдельно необходимо отметить, что диагноз первичной лимфомы желудка у 8% пациентов выявлен при плановом обследовании по поводу сопутствующей патологии и оказался диагностической находкой, так как заболевание у части больных протекало бессимптомно.
В группе пациентов со вторичным поражением желудка от момента установления диагноза первичной локализации процесса до времени выявления поражения желудка сроки были различны и представлены в табл. 2.
Как видно из представленных в таблице данных, поражение желудка в большинстве случаев развилось в первые два года от начала заболевания, что диктует нам необходимость обязательных периодических эндоскопических исследований желудка с целью своевременного выявления метастатического поражения его при лимфомах.
В нашей работе чаще всего при лимфомах желудка имело место инфильтративно-язвенное и инфильтративное его поражение — 28,4% и 21,6% соответственно, затем в 14,8% встречается язвенная форма роста опухоли. Гастритоподобный вариант опухоли отмечен в 14,4%. Реже встречались смешанная и экзофитная формы роста опухоли — 12,0% и 8,8% соответственно.
Причем, как показывает анализ наших данных, при MALT-лимфоме преобладала гастритоподобная форма роста, которая составила 34,3%.
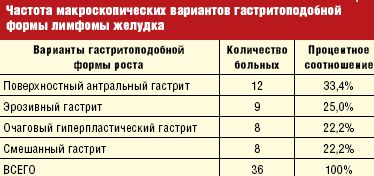
Эндоскопическая картина гастритоподобной формы лимфомы желудка является наиболее вариабельной и по преобладанию макроскопических признаков может проявляться в виде:
Естественно, такое деление является относительно условным, и эти формы выделяются нами по преобладанию наиболее выраженных указанных признаков, симулирующих ту или иную форму гастрита (табл. 3).
Анализируя полученные данные, чаще всего, в 33,4%, отмечался поверхностный антральный гастрит, вторым по частоте стал эрозивный гастрит — 25,0%, с одинаковой частотой в 22,2% встречается очаговый гиперпластический гастрит и смешанный гастрит.
При гастритоподобной форме лимфомы желудка в виде антрального гастрита, как следует из самого определения, визуальные проявления опухоли симулируют воспалительные изменения в антральном отделе желудка, которые отмечены нами в 33,4%. При сохраненной эластичности стенок желудка отмечается пастозность, разрыхленность и очаговая гиперемия слизистой антрального отдела желудка, чередующаяся с участками белесоватого цвета, ее повышенная контактная кровоточивость. Как и при других вариантах, характерным является появление стекловидного блеска. При проведении биопсии подвижность и эластичность слизистой оболочки снижена, отмечается ее фрагментация.
Изменения при лимфоме желудка в виде эрозивного гастрита отмечаются в 25,0% случаев и характеризуются наличием множественных поверхностный острых эрозий неправильной или щелевидной формы на фоне пастозной, неравномерно гиперемированной слизистой с усиленным сосудистым рисунком. Участки эрозий могут локализоваться в различных отделах желудка, чередуясь с неизмененной слизистой, либо занимать изолированную, ограниченную зону. Эластичность стенок остается, как правило, сохраненной или снижена незначительно.
Лимфома желудка в виде локального гиперпластического гастрита. Этот тип лимфомы отмечается в 22,2% случаев и характеризуется умеренным неравномерным утолщением складок на ограниченном участке чаще по большой кривизне и в проксимальном отделе желудка иногда с переходом на переднюю или заднюю стенки. Эластичность стенки сохранена, подвижность складок может быть сохраненной или сниженной. Поверхность складок покрыта вязкой стекловидной слизью, разрыхлена. При инсуффляции складки слизистой пораженного участка, как правило, не расправляются полностью.
В нашем исследовании инфицирование H. pylori было выявлено практически у всех больных при мелкоклеточном варианте и составило 96,7%, при промежуточном варианте MALT-лимфомы желудка — 90%, в отличие от смешанно-клеточных MALT-лимфом, при которых частота инфицирования составила только 53,8%.
При выявлении инфицирования H. pylori мы также определяли степень обсемененности. Оказалось, что при мелкоклеточных MALT-лимфомах высокая частота инфицирования сочетается с выраженной степенью обсемененности чаще (75,9%), чем при других подвариантах. Так, у больных с промежуточным вариантом наличие H. pylori-инфекции сопровождается выраженной степенью обсемененности достоверно реже и выявлено в 38,9%, при смешанных MALT-лифмомах выраженная степень обсемененности установлена у 57,1% пациентов.
Умеренная степень обсемененности при мелкоклеточных опухолях выявлена у 20,7%, при промежуточном варианте чаще — у 61,1%, а при смешанной MALT-лимфоме — у 14,3%.
Слабая степень обсемененности H. pylori встречается у больных MALT-лимфомой желудка крайне редко, она была определена лишь у трех пациентов.
Терапия больных первичной MALT-лимфомой представляет ряд особенностей. Это обусловлено тем, что в мировой практике накоплен относительно небольшой опыт использования всех видов лечебного воздействия — антихеликобактерной терапии, химиотерапии, лучевой терапии, хирургического лечения и их сочетаний.
Антихеликобактерная терапия использовалась нами только при I стадии (классификация Lugano, 1993) MALT-лимфомы желудка мелкоклеточного строения. Лечение проводилось в соответствии с рекомендациями Международного протокола LY03 по изучению MALT-лимфом желудка низкой степени злокачественности [10]. Нами применялась трехкомпонентная схема первой линии эрадикационной терапии, включающая одновременное применение в течение 10–14 дней следующих препаратов:
В результате проведенного лечения у 14 пациентов (87,5%) из 16 больных была достигнута полная ремиссия, у 2 больных (12,5%) констатирована стабилизация заболевания.
Терапевтический эффект антибиотикотерапии реализовался постепенно. Нами установлена последовательность исчезновения проявлений болезни. Первыми ликвидировались клинические симптомы: боль, изжога, тошнота, желудочный дискомфорт.
Вслед за эрадикацией H. pylori постепенно уменьшались визуальные эндоскопические проявления опухолевого поражения: сокращались размеры опухолевого поражения, подслизистой инфильтрации, уменьшался калибр складок слизистой, происходило рубцевание специфических язвенных дефектов, затем восстанавливалась нормальная архитектоника слизистой, исчезала деформация стенок желудка.
Необходимо акцентировать внимание на том, что сроки наступления полного терапевтического эффекта весьма вариабельны. Полная ремиссия, подтвержденная гистологическим и иммунологическим исследованием гастробиоптатов, была диагностирована у больных, получавших антихеликобактерное лечение, в сроки от 2 до 10 месяцев (медиана 5,5 месяцев).
Это означает, что лечение мелкоклеточных MALT-лимфом с применением антихеликобактерных препаратов — это терапия, осуществленная всего за 10–14 дней, но требующая в последующем взвешенного динамического наблюдения и корректной оценки происходящих изменений. Темп наступления полного клинического благополучия является косвенным признаком прогнозирования терапевтического эффекта.
Из 14 больных с подтвержденной полной ремиссией вследствие антихеликобактерной терапии только у одной больной в возрасте 51 год был констатирован рецидив заболевания при контрольном обследовании через 7 месяцев после окончания лечения без каких-либо клинических проявлений. Трактовка эндоскопической картины была сложной: осуществлялась дифференциальная диагностика между эрозивным гастритом и минимальными проявлениями лимфомы. Рецидив был подтвержден иммуноморфологическими исследованиями. В последующем больная получала последовательное лечение Лейкераном (хлорамбуцил), COP с эффектом, который расценен нами как стабилизация заболевания. Учитывая клиническое благополучие, а также наличие тяжелой сопутствующей патологии, было решено хирургическое лечение не применять, а больную оставить под динамическим наблюдением. В течение последующих 36 месяцев больной проводится регулярное обследование (каждые 4–5 месяцев). За этот период наблюдения прогрессирования заболевания не наступило по настоящее время.
Это наблюдение демонстрирует особое свойство мелкоклеточной MALT-лимфомы. Сочетание клинического благополучия с объективными данными стабилизации позволяет длительно наблюдать за больными на фоне проведения регулярного полноценного обследования.
Таким образом, антихеликобактерная терапия правомочна и эффективна при первичных MALT-лимфомах желудка, но при обязательном строгом соблюдении показаний к ее использованию — I стадия процесса с небольшим локализованным поражением слизистого и подслизистого слоев при H. pylori-позитивных опухолях. Обязательным является динамическое исследование опухолевого субстрата на наличие H. pylori, эрадикация которого необходима для реализации противоопухолевого эффекта. Отсутствие эрадикации H. pylori требует использования химиотерапии с повторными курсами антибиотикотерапии.