Лимфоцеле после операции что это такое
Лимфоцеле после операции что это такое
а) Терминология:
1. Синонимы:
• Лимфатическая киста, псевдокиста, лимфокиста
2. Определение:
• Кистозные полости без эпителиальной выстилки, заполненные лимфой
1. Общие характеристики:
• Лучший диагностический критерий:
о Внебрюшинная киста с четкими границами у пациентов после операций в области малого таза
• Локализация:
о Внебрюшинно в малом тазу; парааортально в забрюшинном пространстве
• Морфология:
о Обычно однокамерная тонкостенная киста овоидной формы
2. КТ при послеоперационном лимфоцеле:
• Бесконтрастная КТ:
о Не осложненная киста имеет плотность, близкую к плотности воды
о Редко определяют небольшое количество внутреннего жира (хилюса)
о Редко (в случае хронизации) возможна кальцификация стенки
• КТ с контрастированием:
о Тонкие стенки; отсутствуют контрастное усиление стенки и пристеночный узел
3. МРТ при послеоперационном лимфоцеле:
• Однородный сигнал низкой интенсивности на Т1-ВИ; высокая ИС на Т2-ВИ:
о Т2-ВИ с подавлением сигнала от жировой ткани: отсутствует уменьшение ИС
о МРТ в DWI-режиме: низкая ИС
• Отсутствие усиления после введения внутривенного контраста
о МР-лимфангиография: позволяет установить точный диагноз
4. УЗИ при послеоперационном лимфоцеле:
• УЗИ в режиме серой шкалы:
о Анэхогенное образование с артефактом дистального усиления; иногда определяют перегородки
о В случае осложненной кисты: внутренние эхо-сигналы/уровень фрагментов ткани
• Цветовое допплеровское картирование:
о Отсутствие потока
5. Советы по визуализации:
• Советы по протоколу исследования:
о КТ с контрастным усилением или МРТ: экскреторная томография (более 10 мин.)
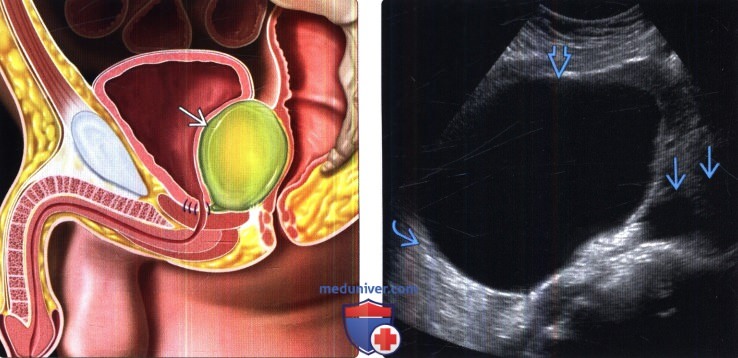
(Справа) УЗИ, трансвагинальный датчик, поперечная плоскость: у пациентки после гистерэктомии с лимфодиссекцией выявлена крупная анэхогенная киста, прилегающая к подвздошным сосудам, что соответствует картине послеоперационного лимфоцеле. Обратите внимание на тонкую стенку и артефакт дистального усиления.
в) Дифференциальная диагностика послеоперационного лимфоцеле:
1. Полостные образования малого таза:
• Уринома: может наполняться контрастом после экскреторной фазы
• Абсцесс: контрастная толстая неровная стенка
• Гематома/эндометриома: составная, компоненты крови
2. Дивертикул мочевого пузыря:
• Прилегает к мочевому пузырю; возможно наличие тонкой шейки к мочевому пузырю
• Помутнение после экскреторной фазы
3. Лимфангиома:
• Множественные образования стонкими перегородками; возможна кальцификация
• Часто вовлекает более одного отдела забрюшинного пространства
4. Псевдомиксома забрюшинного пространства:
• Поликистозное образование, толстые стенки, кальцификаты; правый нижний квадрант
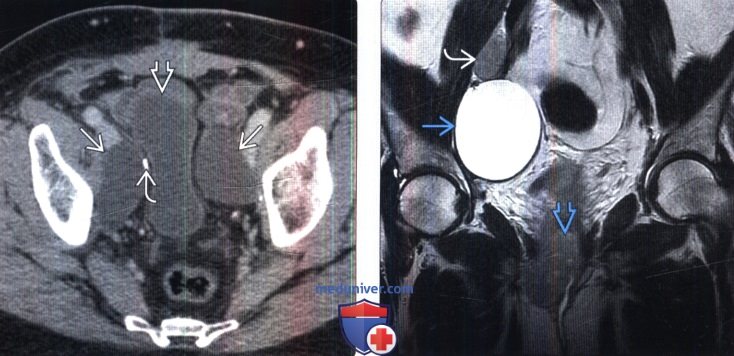
(Справа) МРТ, Т2-ВИ, SS FSE, коронарная проекция: после гистерэктомии и лимфодиссекции по поводу рака шейки матки выявлено ограниченное лимфоцеле с высокой ИС на Т2-ВИ. Обратите внимание на рецидив первичной опухоли и прилегающий к уретре и метастаз в лимфатическом узле.
2. Макроскопические и хирургические признаки:
• Киста с водянистой жидкостью от светло-желтого до желтовато-коричневого цвета
3. Микроскопия:
• Лимфоциты, единичные эритроциты; вариабельно-белок/жир
д) Клинические особенности:
1. Клиническая картина:
• Наиболее распространенные признаки/симптомы:
о Клинические проявления у небольшого числа (
Редактор: Искандер Милевски. Дата публикации: 21.9.2019
Лимфорея и лимфоцеле
Лечение в Инновационном сосудистом центре
В нашей клинике разработаны эффективные хирургические методы лечения лимфореи. Если лимфа продолжает скапливаться дольше месяца после операции, то мы предпринимаем открытую операцию под микроскопом. Выявляются и коагулируются все поврежденные лимфатические сосуды и узлы, полость обрабатывается крепким йодовым раствором и дренируется через отдельный дренаж. Как правило, этого вмешательства достаточно, для ликвидации лимфореи. В сложных случаях мы проводим трансплантацию сальника в паховую область, чтобы он всасывал лимфатическую жидкость.
Осложнения лимфореи
Есть два серьезных осложнения, которые возникают при лимфорее.
Лимфатическая жидкость-это естественная «пища» для бактерий. Открытая дренажная рана входными воротами для инфекции. Это приводит к флегмонам, лимфангитам или рожистому воспалению.
Лимфорея при контакте с кожей может разъедать ее и вызывать воспаление (дерматит). Раны могут прогрессивно увеличиваться и даже потребовать в последующем реконструктивно-пластических операций для их закрытия.
Прогноз при лимфорее
В большинстве случаев послеоперационная лимфорея прекращается со временем при применении консервативных мероприятий. Если истечение лимфы обильное и продолжается больше месяца, то необходимо планировать хирургическое лечение, направленное на перекрытие источника лимфоистечения.
Хирургическое лечение требуется примерно в 10% случаев лимфореи.
Лимфатические кисты после хирургического лечения онкогинекологических больных: факторы риска, диагностика и лечение
Полный текст:
Аннотация
Лимфатические кисты, или лимфоцеле – одно из самых частых осложнений тазовой и парааортальной лимфодиссекции у онкогинекологических больных. Несмотря на широкую встречаемость данного осложнения, в современной литературе не определены оптимальные рекомендации по лечению и диагностике лимфоцеле. В статье приводится обсуждение и анализ данных литературы о частоте возникновения лимфатических кист, факторах риска их формирования и существующих методах диагностики и лечения.
Ключевые слова
Об авторах
Татьяна Томовна Роговская
197758 Санкт-Петербург, пос. Песочный, ул. Ленинградская, 68
197758 Санкт-Петербург, пос. Песочный, ул. Ленинградская, 68,
191015 Санкт-Петербург, ул. Кирочная, 41
Список литературы
1. Ballester M., Bendifallah S., Daraï E. European guidelines (ESMO-ESGOESTRO consensus conference) for the management of endometrial cancer. Bull Cancer 2017;104(12):1032–8. PMID: 29173977. DOI: 10.1016/j.bulcan.2017.10.006.
2. Cibula D., Pötter R., Planchamp F. et al. The European Society of Gynaecological Oncology/European Society for Radiotherapy and Oncology/European Society of Pathology guidelines for the management of patients with cervical cancer. Radiother Oncol 2018;127(3):404–16. PMID: 29728273. DOI: 10.1016/j.radonc.2018.03.003.
3. Weinberger V., Cibula D., Zikan M. Lymphocele: prevalence and management in gynecological malignancies. Expert Rev Anticancer Ther 2014;14(3):307–17. PMID: 24483760. DOI: 10.1586/14737140.2014.866043.
4. Ghezzi F., Uccella S., Cromi A. et al. Lymphoceles, lymphorrhea, and lymphedema after laparoscopic and open endometrial cancer staging. Ann Surg Oncol 2012;19(1):259–67. PMID: 21695563. DOI: 10.1245/s10434-011-1854-5.
5. Ilancheran A., Monaghan J.M. Pelvic lymphocyst – a 10-year experience. Gynecol Oncol 1988;29(3):333–6. PMID: 3345953.
6. Mori N. Clinical and experimental studies on the so-called lymphocyst which develops after radical hysterectomy in cancer of the uterine cervix. J Jpn Obstet Gynecol Soc 1955;2(2):178–203. PMID: 13286539.
7. Tam K.F., Lam K.W., Chan K.K., Ngan H.Y. Natural history of pelvic lymphocysts as observed by ultrasonography after bilateral pelvic lymphadenectomy. Ultrasound Obstet Gynecol 2008;32(1):87–90. PMID: 18548478. DOI: 10.1002/uog.5345.
8. McMahon C.J., Rofsky N.M., Pedrosa I. Lymphatic metastases from pelvic tumors: anatomic classification, characterization, and staging. Radiology 2010;254:31–46. PMID: 20032141. DOI: 10.1148/radiol.2541090361.
9. Lengele B., Scalliet P. Anatomical bases for the radiological delineation of lymph node areas. Part III: Pelvis and lower limbs. Radiother Oncol 2009;92(1):22–33. PMID: 19095323. DOI: 10.1016/j.radonc.2008.11.007.
10. Hedgire S.S., Pargaonkar V.K., Elmi A. et al. Pelvic nodal imaging. Radiol Clin North Am 2012;50(6):1111–25. PMID: 23122041. DOI: 10.1016/j.rcl.2012.08.002.
11. Tinelli A., Mynbaev O.A., Tsin D.A. et al. Lymphocele prevention after pelvic laparoscopic lymphadenectomy by a collagen patch coated with human coagulation factors: a matched case-control study. Int J Gynecol Cancer 2013;23(5):956–63. PMID: 23574881. DOI: 10.1097/IGC.0b013e31828eeea4.
12. Yin H., Gui T. Comparative analyses of postoperative complications and prognosis of different surgical procedures in stage II endometrial carcinoma treatment. Onco Targets Ther 2016;9:781–6. PMID: 26937200. DOI: 10.2147/OTT.S95806.
13. Kim Y.H., Shin H.J., Ju W., Kim S.C. Prevention of lymphocele by using gelatinthrombin matrix as a tissue sealant after pelvic lymphadenectomy in patients with gynecologic cancers: a prospective randomized controlled study. J Gynecol Oncol 2017;28(3):e37. PMID: 28382800. DOI: 10.3802/jgo.2017.28.e37.
14. Hiramatsu K., Kobayashi E., Ueda Y. et al. Optimal timing for drainage of infected lymphocysts after lymphadenectomy for gynecologic cancer. Int J Gynecol Cancer 2015;25(2):337–41. PMID: 25594145. DOI: 10.1097/IGC.0000000000000353.
15. Kondo E., Tabata T., Shiozaki T. et al. Large or persistent lymphocyst increases the risk of lymphedema, lymphangitis, and deep vein thrombosis after retroperitoneal lymphadenectomy for gynecologic malignancy. Arch Gynecol Obstet 2013;288(3):587–93. PMID: 23455541. DOI: 10.1007/s00404-013-2769-0.
16. Олейник В.В. Лимфатические кисты после расширенных операций по поводу рака шейки матки и тела матки. Автореф. дис. … канд. мед. наук. СанктПетербург, 1996. 25 с.
17. Kim H.Y., Kim J.W., Kim S.H. et al. An analysis of the risk factors and management of lymphocele after pelvic lymphadenectomy in patients with gynecologic malignancies. Cancer Res Treat 2004;36(6):377–83. PMID: 20368832. DOI: 10.4143/crt.2004.36.6.377.
18. Charoenkwan K., Kietpeerakool C. Retroperitoneal drainage versus no drainage after pelvic lymphadenectomy for the prevention of lymphocyst formation in women with gynaecological malignancies. Cochrane Database Syst Rev 2017;6:CD007387. DOI: 10.1002/14651858.CD007387.pub4.
19. Achouri A., Huchon C., Bats A.S. et al. Complications of lymphadenectomy for gynecologic cancer. Eur J Surg Oncol 2013;39(1):81–6. PMID: 23117018. DOI: 10.1016/j.ejso.2012.10.011.
20. Zikan M., Daniela F., Pinkavova I. et al. A prospective study examining the incidence of asymptomatic and symptomatic lymphoceles following lymphadenectomy in patients with gynecological cancer. Gynecol Oncol 2015;137(2):291–8. PMID: 25720294. DOI: 10.1016/j.ygyno.2015.02.016.
21. Symmond R. Morbidity and complications of radical hysterectomy with pelvic lymph node dissection. Am J Obstet Gynecol 1966;94(5):663–78. PMID: 5906590.
22. Степанов С.О., Новикова Е.Г., Скрепцова Н.С. Ультразвуковая диагностика и тактика при лимфоцеле после онкогинекологических операций. Сибирский онкологический журнал 2009;2(32):25–30.
23. De Blasis I., Vinci V., Sergi M.E. et al. Early and late onset complications of gynaecologic surgery: a multimodality imaging approach. Facts Views Vis Obgyn 2017;9(1):5–14. PMID: 28721179.
24. Vansonnenberg E., Wittich G.R., Casola G. et al. Lymphoceles: imaging characteristics and percutaneous management. Radiology 1986;161(3):593–6. PMID: 3538133. DOI: 10.1148/radiology.161.3.3538133.
25. Францев Д.Ю. Послеоперационные лимфатические кисты таза: аналитический обзор. Клиническая и экспериментальная хирургия. Журнал им. акад. Б.В. Петровского 2015;(4):113–20.
26. Petru E., Tamussino K., Lahousen M. et al. Pelvic and paraaortic lymphocysts after radical surgery because of cervical and ovarian cancer. Am J Obstet Gynecol 1989;161(4):937–41. PMID: 2801842.
27. Sahbaz A., Gungorduk K., Gulseren V. et al. What are the risk factors for lymphocyst formation apart from lymphnode dissection and lymphnode count in gynecologic malignancy? Geburtsh Frauenheilk 2016;76(4):403–7. DOI: 10.1055/s-0041-110804.
28. Кедрова А.Г., Шабловский О.Р., Леваков С.А. и др. Возможности применения низкомолекулярных гепаринов в комплексном лечении женщин с опухолями женской репродуктивной системы. Опухоли женской репродуктивной системы 2017;13(2):47–55.
29. Baraem Y., Ahn H., Kim M. et al. Nomogram predicting risk of lymphocele in gynecologic cancer patients undergoing pelvic lymph node dissection. Obstet Gynecol Sci 2017;60(5):440–8. PMID: 28989920. DOI: 10.5468/ogs.2017.60.5.440.
30. Van Nagell J., Schweitz D. Surgical adjuncts in radical hysterectomy and pelvic lymphadenectomy. Surg Gynecol Obstet 1976;143(5):735–7. PMID: 790612.
31. Бохман Я.В. Руководство по онкогинекологии. Л.: Медицина, 1989. 464 c.
32. Benedetti-Panici P., Maneschi F., Cutillo G. et al. A randomized study comparing retroperitoneal drainage with no drainage after lymphadenectomy in gynecologic malignancies. Gynecol Oncol 1997;65(3):478–82. PMID: 9190979.
33. Franchi M., Trimbos J., Zanaboni F. et al. Randomised trial of drains versus no drains following radical hysterectomy and pelvic lymph node dissection: a European Organisation for Research and Treatment of Cancer-Gynaecological Cancer Group (EORTC-GCG) study in 234 patients. Eur J Cancer 2007;43(8):1265–8. PMID: 17466514. DOI: 10.1016/j.ejca.2007.03.011.
34. Suzuki M., Ohwada M., Sato I. Pelvic lymphocysts following retroperitoneal lymphadenectomy: retroperitoneal partial “no-closure” for ovarian and endometrial cancers. J Surg Oncol 1998;68(3):149–52.
35. Thome Saint Paul M., Bremond A., Rochet Y. Absence of peritonization after pelvic cancer surgery. Results in 157 cases. J Gynecol Obstet Biol Reprod 1991;20(7):957–60.
36. Franchi M., Ghezzi F., Zanaboni F. et al. Nonclosure of peritoneum at radical abdominal hysterectomy and pelvic node dissection: a randomized study. Obstet Gynecol 1997;90(4 Pt 1):622–7. PMID: 9380327.
37. Radosa M.P., Diebolder H., Camara O. et al. Laparoscopic lymphocele fenestration in gynaecological cancer patients after retroperitoneal lymph node dissection as a first-line treatment option. BJOG 2013;120(5):628–36. PMID: 23320834. DOI: 10.1111/1471-0528.12103.
38. Karcaaltincaba M., Akhan О. Radiologic imaging and percutaneous treatment of pelvic lymphocele. Eur J Radiol 2005;55(3):340–54. PMID: 15885959. DOI: 10.1016/j.ejrad.2005.03.007.
39. Kim J.K., Jeong Y.Y., Kim Y.H. et al. Postoperative pelvic lymphocele: treatment with simple percutaneous catheter drainage. Radiology 1999;212(2):390–4.
40. Conte M., Panici P.B., Guariglia L. et al. Pelvic lymphocele following radical para-aortic and pelvic lymphadenectomy for cervical carcinoma: incidence rate and percutaneous management. Obstet Gynecol 1990;76(2):268–71. PMID: 2196500.
41. Teruel J.L., Escobar E.M., Quereda C. et al. A simple and safe method for management of lymphocele after renal transplantation. J Urol 1983;130(6):1058–9. PMID: 6358528.
42. Alago W.Jr., Deodhar A., Michell H. et al. Management of postoperative lymphoceles after lymphadenectomy: percutaneous catheter drainage with and without povidone-iodine sclerotherapy. Cardiovasc Intervent Radiol 2013;36(2):466–71. PMID: 22484702. DOI: 10.1007/s00270-012-0375-3.
43. Rivera M., Marcen R., Burgos J. et al. Treatment of posttransplant lymphocele with povidone-iodine sclerosis: long-term follow-up. Nephron 1996;74(2):324–7. PMID: 8893149. DOI: 10.1159/000189329.
44. Zuckerman D.A., Yeager T.D. Percutaneous ethanol sclerotherapy of postoperative lymphoceles. Am J Roentgenol 1997;169(2):433–7. PMID: 9242748. DOI: 10.2214/ajr.169.2.9242748.
45. Elsandabesee D., Sharma B., Preston J. et al. Sclerotherapy with bleomycin for recurrent massive inguinal lymphoceles following partial vulvectomy and bilateral lymphadenectomy – case report and literature review. Gynecol Oncol 2004;92(2):716–8. PMID: 14766274. DOI: 10.1016/j.ygyno.2003.11.007.
46. Fernandes A.S., Costa A., Mota R. et al. Bleomycin sclerotherapy for severe symptomatic and persistent pelvic lymphocele. Case Rep Obstet Gynecol 2014;2014:624803. DOI: 10.1155/2014/624803.
47. Kurata H., Aoki Y., Tanaka K. Simple one-step catheter placement for the treatment of infected lymphocele. Eur J Obstet Gynecol Reprod Biol 2003;106(1):69–71. PMID: 12475585.
48. Kawamura I., Hirashima Y., Tsukahara M. et al. Microbiology of pelvic lymphocyst infection after lymphadenectomy for malignant gynecologic tumors. Surg Infect (Larchmt) 2015;16(3):244–6. PMID: 25651071. DOI: 10.1089/sur.2014.021.
Для цитирования:
Роговская Т.Т., Берлев И.В. Лимфатические кисты после хирургического лечения онкогинекологических больных: факторы риска, диагностика и лечение. Опухоли женской репродуктивной системы. 2018;14(4):72-79. https://doi.org/10.17650/1994-4098-2018-14-4-72-79
For citation:
Rogovskaya Т.Т., Berlev I.V. Lymphatic cysts after gynecological cancer surgery: risk factors, diagnosis and treatment. Tumors of female reproductive system. 2018;14(4):72-79. (In Russ.) https://doi.org/10.17650/1994-4098-2018-14-4-72-79
Лимфоцеле после операции что это такое
Кафедра военно-полевой хирургии Института усовершенствования врачей медицинского учебно-научного клинического центра им. П.В. Мандрыка МО РФ, Москва
Клиника ФГБОУ ВО «Южно-Уральский государственный медицинский университет» Минздрава России, Челябинск, Россия
Кафедра микробиологии, иммунологии и общей биологии ФГБОУ ВО «Челябинский государственный университет», Челябинск, Россия
Профилактика длительной и обильной лимфореи при раке молочной железы
Журнал: Онкология. Журнал им. П.А. Герцена. 2020;9(3): 34-40
Богданов А. В., Куракина И. С., Нохрин Д. Ю. Профилактика длительной и обильной лимфореи при раке молочной железы. Онкология. Журнал им. П.А. Герцена. 2020;9(3):34-40.
Bogdanov A V, Kurakina I S, Nokhrin D Yu. Prevention of prolonged and profuse lymphorrhea in breast cancer. P.A. Herzen Journal of Oncology. 2020;9(3):34-40.
https://doi.org/10.17116/onkolog2020903134
Кафедра военно-полевой хирургии Института усовершенствования врачей медицинского учебно-научного клинического центра им. П.В. Мандрыка МО РФ, Москва
Хирургический метод представляет собой основной этап лечения рака молочной железы. Одним из постоянных ранних послеоперационных осложнений является лимфорея, которая длится в большинстве случаев 8—14 сут, но у 30% больных продолжается 30—60 сут. Эффективное ведение послеоперационного периода позволяет продолжить комбинированное лечение рака молочной железы в установленные сроки и влияет на общий результат лечения злокачественных новообразований. Цель исследования — повысить эффективность профилактических мероприятий по снижению длительности и объема лимфореи. Материал и методы. Проанализированы результаты хирургического лечения 144 больных раком молочной железы. Операция Маддена выполнена 93 (64,6%) пациенткам, Пейти — 29 (20,1%), радикальная резекция молочной железы — 22 (15,3%). Изучены факторы, оказывающие влияние на объем и длительность лимфореи (возраст, индекс массы тела, размер и гистологический тип опухоли, сопутствующая патология, вид операции). Все больные были разделены на пять групп в зависимости от примененного способа профилактики послеоперационной лимфореи: снижение мощности электрического тока при диссекции тканей, использование пластики подмышечной ямки, фиксации кожных лоскутов к грудной стенке. Результаты. Понижение мощности электрогенератора при диссекции тканей достоверно уменьшает объем лимфоистечения (р=0,026). Применение пластики подмышечной ямки и фиксация кожных лоскутов к грудной клетке способствуют снижению количества лимфореи в послеоперационном периоде (р=0,041). Оптимальная комбинация, позволяющая сократить объем и продолжительность лимфореи, — использование низкоэнергетического режима электрокоагулятора (25 Вт), мио-пластики подмышечной ямки и фиксации лоскутов к грудной клетке (применяли попарные апостериорные сравнения групп пациентов методом Ньюмена—Кейлса (р=0,009)). Выводы. Сочетание способов, найденное для профилактики, уменьшает продолжительность лимфоистечения и сроки пребывания пациенток в стационаре.
Кафедра военно-полевой хирургии Института усовершенствования врачей медицинского учебно-научного клинического центра им. П.В. Мандрыка МО РФ, Москва
Клиника ФГБОУ ВО «Южно-Уральский государственный медицинский университет» Минздрава России, Челябинск, Россия
Кафедра микробиологии, иммунологии и общей биологии ФГБОУ ВО «Челябинский государственный университет», Челябинск, Россия
Рак молочной железы занимает первое место в структуре онкологической заболеваемости женщин, составляя в Российской Федерации 471,5 случая на 100 тыс. населения в 2018 г. [1].
Хирургический метод является одним из основных этапов лечения. Эффективное ведение послеоперационного периода позволяет продолжить комбинированное лечение рака молочной железы в установленные сроки и влияет на общий результат лечения злокачественных новообразований [2].
При невозможности выполнения биопсии сторожевого лимфатического узла или выявлении метастатического поражения сторожевого лимфатического узла выполняется подмышечная лимфаденэктомия (I—III уровня). Одним из постоянных ранних послеоперационных осложнений является лимфорея, связанная с механическим пересечением большого количества лимфатических сосудов различного калибра и образованием полости вследствие недостаточного прилегания кожных лоскутов к грудной клетке. Послеоперационное лимфоистечение длится в большинстве случаев 8—14 сут, но у 30% больных продолжается 30—60 сут [3].
В настоящее время существует несколько направлений в профилактике лимфореи:
— уменьшение «мертвого пространства» за счет подшивания кожно-жировых лоскутов и закрытия аксиллярной области, применение давящих, компрессионных повязок [4—6];
— физические методы воздействия (диссекция с помощью ультразвукового скальпеля, использование лазерного излучения, плазменная коагуляция и др.) [2, 7];
— использование сеалентов (герметиков) [8];
— лекарственная терапия (применение октреотида, ингибиторов фибринолиза, глюкокортикоидов и др.) [9].
Однако, по данным литературы, частота развития послеоперационной лимфореи до сих пор остается достаточно высокой (5—87,5%), что приводит к долгосрочной потере трудоспособности больных. Скопление лимфы в больших количествах может вызвать воспалительные изменения в области послеоперационной раны, нагноение, расхождение краев раны, что требует дополнительного лечения в условиях стационара. Часто в связи с продолжительным лимфоистечением пропускаются оптимальные сроки начала химиотерапевтического и/или лучевого лечения [2, 10]. С большим постоянством лимфорея способствует выраженным рубцовым изменениям в области лимфаденэктомии, является причиной формирования лимфедемы верхней конечности, которая сама по себе приводит к ухудшению качества жизни, а зачастую и к инвалидизации больных, находящихся в социально активном возрасте.
Таким образом, послеоперационная лимфорея по-прежнему остается актуальной хирургической проблемой, а обилие методов ее профилактики говорит об отсутствии успеха в предотвращении лимфоистечения при использовании какого-либо одного способа.
Цель исследования — повышение эффективности профилактических мероприятий по снижению длительности и объема лимфореи.
Материал и методы
В исследование включили 144 пациентки после различных вариантов хирургических операций по поводу рака молочной железы.
Возраст пациенток варьировал от 33 до 89 лет и составил в среднем 61,6 года (95% ДИ от 54 до 68). Индекс массы тела составил 19—51, в среднем 29,2 (95% ДИ от 28,3 до 30,1). Не имели сопутствующих заболеваний 49 (34%) женщин. У 95 (66%) были отмечены: ИБС, гипертоническая болезнь, сахарный диабет и их комбинации. Гипертоническая болезнь изолированно была у 64 пациенток, сахарный диабет — у 2 женщин, а ИБС — только у 1. Комбинацию двух заболеваний регистрировали в 32 случаях. Сочетание всех трех патологий отмечено у 5 пациенток.
Все больные, находившиеся под наблюдением, в зависимости от стадии заболевания были распределены следующим образом (табл. 1).

По морфологическому строению выявленные опухоли многообразны и полиморфны. Наиболее часто встречался инвазивный рак без признаков специфичности (NST) — в 110 (76,4%) случаях. Инвазивный дольковый рак наблюдался у 25 (17,4%) больных, муцинозный рак — у 8 (5,6%), рак с признаками медуллярности — у 1 (0,7%) пациентки.
Операция Маддена выполнена 93 (64,6%) пациенткам, Пейти — 29 (20,1%), радикальная резекция молочной железы — 22 (15,3%). Для выделения ткани молочной железы, отсечения молочной железы от грудной клетки и при выполнении лимфаденэктомии использовали электрогенератор Force Triad Liga Sure (Valleylab, США). Скальпель и ножницы применяли только для рассечения поверхностных слоев кожи и пересечения сосудистых пучков после их лигирования. Гемостаз осуществляли путем электрокоагуляции.
Для профилактики лимфореи использовали следующие методы:
— Снижение мощности электрического тока. Ретроспективно оценено, что при выполнении диссекции тканей молочной железы использовали электрогенератор с мощностью электрического тока 45 Вт. При наборе пациентов в группы исследования мощность электрического тока была снижена эмпирически до 25 Вт.
— Пластика подмышечной ямки. После удаления молочной железы, лимфатических коллекторов и клетчатки единым блоком выполняли миопластику полностью отсеченной каудально малой грудной мышцей. Мышцу перемещали в подмышечную область, укладывали поверх и вдоль сосудистого пучка и подшивали узловыми швами к лестничной и широчайшей мышцам.
— Фиксация кожных лоскутов к грудной клетке рассасывающимся шовным материалом на атравматичной игле с целью ликвидации «свободного пространства» для скопления раневого экссудата.
Операцию у всех больных заканчивали дренированием раны с помощью систем для активного вакуумного дренирования. В послеоперационном периоде всем больным с первых суток накладывали компрессионные повязки на область операции, выполняли тугое бинтование грудной клетки эластичными бинтами.
Измерение количества выделяемой по дренажам лимфы пациенткам проводили с помощью градуированных колб с записью показателей в специальных бланках подсчета лимфы [2]. После того как объем суточного отделяемого уменьшался до 50—60 мл/сут, дренажи удаляли и проводили подсчет количества лимфы, эвакуируемой врачом пункционно, с последующим ведением записей. Для количественной оценки, длительности лимфореи и конечной статистической обработки данных показатели измерений фиксировали на 1, 3, 5, 7, 10, 12, 15, 18, 21-е и 23-и сутки после операции.
В ходе статистического анализа полученных данных использовали методы описательной статистики, поиска связей, сглаживания зависимостей и выборочных сравнений. Для описания качественных признаков рассчитывали абсолютные и относительные (в %) частоты. Для количественных признаков определяли минимум и максимум, медиану и квартили, а также среднее значение с 95% ДИ, вычисленное при помощи процедуры непараметрического бутстепа (метод процентилей, n=99999). При поиске связей использовали ранговую корреляцию Спирмена. Для визуализации динамики лимфореи применяли кубические сплайны с оптимизированным по результатам кросс-проверки параметром сглаживания [11]. Для сравнения суточной лимфореи в группах с разными типами операций (Пейти, Маддена или радикальная резекция молочной железы) или вариантами лечения (табл. 2) использовали перекрестно-иерархические модели трехфакторного дисперсионного анализа с факторами:
— «группа» (фиксированный, 3 градации для типов операций и 5 градаций для вариантов лечения);
— «время» (фиксированный, 7 градаций, соответствующих 1, 3, 5, 7, 10, 12 и 15-м суткам);
— «пациент внутри группы» (случайный, от 10 до 63 градаций).

При отличии распределения показателя «среднесуточный объем лимфы» и остатков модели от нормального распределения данные предварительно обрабатывали с использованием нормализующего преобразования Бокса—Кокса. Апостериорные сравнения в рамках рассчитанных моделей проводили с помощью критерия Ньюмена—Кейлса. Расчеты выполнены в пакетах PAST (v. 3.21 (Hammer и соавт., 2001)) и Statistica (v. 12.0, StatSoft Inc.). Во всех случаях статистически значимыми считали эффекты при p≤0,05.
Результаты
Были изучены особенности послеоперационного периода у пациенток после хирургического лечения рака молочной железы для поиска факторов, определяющих степень лимфореи, а также проведена оценка влияния методов профилактики на уровень лимфореи.
Влияние на объем лимфореи. По результатам исследования обнаружена слабая положительная связь между ИМТ пациенток и объемом лимфореи на 1, 5 и 7-е сутки послеоперационного периода: коэффициент корреляции Спирмена rS=0,3 (p=0,0003).
При изучении влияния размера опухоли в молочной железе и количества пораженных метастазами лимфатических узлов, по данным гистологического исследования, не выявлено корреляционных связей между этими показателями и объемом лимфореи (p от 0,057 до 0,664). Однако найдена слабая корреляционная связь между длительностью оперативного пособия и величиной лимфо- истечения на 1, 5 и 7-е сутки: rS=0,30 (p=0,028).
Мощность электрогенератора 45 или 25 Вт коррелировала с объемом лимфореи с первых по 15-е сутки послеоперационного периода. Найдена прямая слабая корреляционная связь rS=0,23 (p от 0,007 до 0,026).
Использование пластики подмышечной ямки и фиксации кожно-жировых лоскутов также оказывало влияние на количество лимфы в послеоперационном периоде. Применение миопластики статистически значимо снижало объем лимфоистечения с первых по 7-е сутки (rS –0,24 до –0,20 к 7-м суткам) (p от 0,003 до 0,041). Фиксация кожно-жировых лоскутов к грудной стенке оказалась статистически значимо связана с лимфореей на протяжении 1—15 сут после операции. Коэффициент корреляции rS от –0,30 до –0,16 к 7-м суткам (p от 0,0001 до 0,004). Корреляционная связь отрицательная, что говорит об уменьшении количества лимфы при использовании этих методик.
По данным нашего анализа, на протяжении всего послеоперационного периода исходный объем лимфореи влиял на количество выделяющейся лимфы в последующем. Так, например, дебит лимфы на первые сутки коррелировал с объемом лимфы с 3-х по 18-е сутки. Количество лимфы на 3-и сутки коррелировало с объемом выделяющейся лимфы с 5-х по 15-е сутки и т.д. Найдены статистически значимые прямые корреляционные зависимости между этими показателями. Коэффициент корреляции rS от 0,4 до 0,76 (p=0,00001) демонстрирует умеренную и сильную зависимость.
По результатам исследования установлено, что возраст, гистологический тип опухоли и наличие сопутствующей патологии не оказывали влияния на продолжительность и объем лимфореи.
Влияние на лимфорею варианта операции. На протяжении исследования в различные сроки послеоперационного периода (n=1025 измерений) суточная лимфорея варьировала от 0 до 500 мл при медианном значении в 70 мл и среднем значении 90 мл (95% ДИ от 85 до 94).
Для сравнения лимфореи в группах с разными вариантами операций (Маддена, Пейти и радикальная резекция молочной железы) с учетом повторных измерений у одних и тех же пациенток на разных сроках после операции использовали смешанную модель дисперсионного анализа после предварительного преобразования данных по суточным объемам лимфы по Боксу—Коксу (λ=0,383). Поскольку число пациенток, начиная с 16-х суток после операции, было крайне мало, в анализ были включены данные только по 7 временным точкам (с первых по 15-е сутки). Результаты представлены в табл. 3 и на рис. 1.


Здесь и далее сглаживание оптимальным сплайном.
Из табл. 3 видно, что статистически значимыми оказались динамика изменения лимфореи во времени (фактор «время» после операции), проявившаяся в снижении суточного объема с первых к 15-м суткам после операции (см. рис. 1), и индивидуальные различия между пациентками по среднему суточному объему лимфы. Несмотря на несколько более высокие значения лимфореи в группе радикальной резекции молочной железы, различия между тремя типами операций (фактор «группа») не были статистически значимыми; также не наблюдалось различий в характере динамики лимфореи после операций (взаимодействие факторов «группа—время»).
Влияние на лимфорею комбинации профилактических мероприятий. На втором этапе был проведен углубленный анализ влияния факторов, направленных на снижение суточного объема лимфы. Все больные были разделены на пять групп в зависимости от примененного способа профилактики послеоперационной лимфореи (табл. 3).
В обследуемую 1-ю группу вошли 63 пациентки, которым произвели радикальные вмешательства на молочной железе. Использовали режим электрокоагуляции 45 Вт.
Во 2-ю группу включили 18 пациенток, которым после стандартной операции выполнили фиксацию кожных лоскутов к грудной стенке. Для диссекции тканей и гемостаза был выбран режим 45 Вт.
В 3-й группе (33 пациентки) также после оперативного вмешательства кожные лоскуты подшивали к подлежащим мышцам грудной стенки, применяемый режим электрокоагуляции выбрали 25 Вт.
В 4-й группе (10 пациенток) использовали миопластику подмышечной ямки и фиксацию кожных лоскутов к мышцам грудной стенки. В этой группе был применен режим электрохирургического воздействия 45 Вт.
5-ю группу (20 пациенток) отличал от 4-й только выбранный режим электрогенератора — 25 Вт.
Для сравнения динамики лимфореи в пяти группах использовали смешанную модель дисперсионного анализа после предварительного преобразования данных по суточным объемам лимфы по Боксу—Коксу (λ=0,399). Результаты представлены в табл. 4.

Статистически значимыми оказались следующие факторы:
— индивидуальные различия между пациентками по объему и длительности лимфореи после операции (фактор «пациенты»).
— снижение объема лимфоистечения у всех пациенток к 15-м суткам послеоперационного периода (фактор «время после операции») (рис. 2).
— зависимость объема лимфореи от способа профилактики в послеоперационном периоде.

В то же время не отмечены статистические различия длительности лимфореи у пациенток в пяти выделенных группах (взаимодействие факторов «вариант профилактики—время после операции»). Лимфоистечение наблюдалось во всех группах пациентов до 23-х суток включительно. Однако к 18-м суткам в 3, 4 и 5-й группах лимфорея отмечена лишь у 22 (30%) больных. В 70% случаях скопление лимфы было минимальным и не требовало эвакуации, поэтому пациенток исключали из исследования и выписывали на амбулаторный этап лечения.
В табл. 5 представлены объемы лимфоистечения в пяти группах пациенток в разные сроки после операции.

Для определения наиболее результативного варианта профилактики лимфореи проведены попарные апостериорные сравнения групп пациентов методом Ньюмена—Кейлса для того, чтобы выявить, какие группы особенно сильно отличались друг от друга. Сравнения показали статистически значимые различия между 1-й и 5-й группами (р=0,009), а также между 2-й и 5-й группами (р=0,035) (табл. 6).

Таким образом, у пациенток, которым выполняли пластику подмышечной ямки, фиксацию лоскутов к грудной клетке и использовали пониженную мощность электрогенератора 25 Вт, лимфорея была значительно менее выражена с первых суток послеоперационного периода и заканчивалась раньше по сравнению с пациентками 1-й и 2-й групп. Статистических различий между объемом и длительностью лимфоистечения в 3-й и 4-й группах не получено.
Выводы
Участие авторов:
Концепция и дизайн исследования — А.В.Б, И.С.К.
Сбор и обработка материала — А.В.Б., И.С.К.
Статистическая обработка — Д.Ю.Н.
Написание текста — А.В.Б., И.С.К.
Редактирование — А.В.Б., И.С.К., Д.Ю.Н.
Авторы заявляют об отсутствии конфликта интересов.
