Лимфоцитарная инфильтрация стромы что это
Лимфоцитарная инфильтрация Джесснера-Канофа
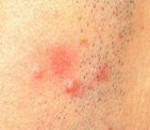
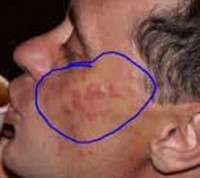
Лимфоцитарная инфильтрация Джесснера-Канофа – редкий хронический дерматоз, характеризующийся доброкачественной инфильтрацией кожи лимфоцитами. Заболевание имеет волнообразное течение, склонно к саморазрешению. Клинически проявляется высыпанием на неизменённой коже плоских гладких синюшно-розовых бляшек или папул, которые сливаются в очаги величиной с ладонь ребенка или взрослого. Первичные элементы имеют чёткие границы, шелушатся. Бляшки обычно единичные, располагаются на лице, шее, туловище, конечностях. Диагностируется клинически с гистологическим подтверждением, иногда проводят молекулярно-биологические исследования. Лечение – НПВС, гормональная терапия, препараты местного действия.
Общие сведения
Лимфоцитарная инфильтрация Джесснера-Канофа – доброкачественная псевдолимфома кожи с хроническим волнообразным рецидивирующим течением. Встречается редко. Чаще возникает у мужчин старше 20 лет. Сезонных, расовых различий не имеет, не эндемична. Иногда наблюдается улучшение в летний период. Впервые данная патология была описана в 1953 году, когда М. Джесснер и Н. Каноф рассмотрели ее как самостоятельное заболевание со сквозной инфильтрацией лимфоцитами всех слоёв дермы. Название «псевдолимфома» в 1965 году ввел К. Мач, объединивший инфильтрацию Джесснера-Канофа в одну группу с другими разновидностями лимфоцитарной инфильтрации.
В 1975 году О. Браун отдифференцировал тип заболевания, отнеся инфильтрацию лимфоцитами к В-клеточным псевдолимфомам, однако позже специалисты стали рассматривать патологию как Т-псевдолимфому. Именно Т-лимфоциты обеспечивают доброкачественное течение патологии и возможность спонтанной инволюции первичных элементов. Дальнейшие исследования показали, что в возникновении и течении лимфоцитарной инфильтрации Джесснера существенную роль играет иммунная система организма. Возможно, это связано с тем, что клетки иммунной системы располагаются в пищеварительном тракте, а он поражается в 70% случаев заболевания. Изучение лимфоцитарной инфильтрации Джесснера-Канофа продолжается и в настоящее время. Понимание причин возникновения и развития Т-лимфоидных процессов имеет большое значение в разработке патогенетического лечения псевдолимфом.
Причины лимфоцитарной инфильтрации
Наиболее вероятными причинами лимфоцитарной инфильтрации Джесснера-Канофа принято считать гиперинсоляцию, укусы клещей, инфекции, патологию желудочно-кишечного тракта, использование дерматогенной косметики и нерациональный приём лекарственных препаратов, провоцирующих системные иммунные нарушения, визуально представленные инфильтративными изменениями в коже. Механизм лимфоцитарной инфильтрации Джесснера-Канофа заключается в следующем: интактный эпидермис даёт Т-лимфоцитам возможность инфильтрировать глубокие слои дермы, располагаясь в сосочковых выростах и вокруг сосудистых сплетений по всей толще кожи. Триггеры заболевания запускают воспаление, на которое реагируют непосредственно клетки кожи и клетки иммунной системы. В процесс купирования воспаления включаются Т-лимфоциты, обеспечивающие доброкачественный ответ иммунной системы в виде пролиферации эпителиальных клеток дермы.
Одновременно в коже развивается банальное воспаление, проходящее три стадии: альтерации, экссудации и пролиферации с участием гистиоцитов – клеток ретикулярной ткани. Гистиоциты группируются и образуют островки, напоминающие лимфоидные фолликулы. На конечном этапе купирования воспаления два параллельных процесса пролиферации дополняют и усиливают друг друга. Так возникает очаг лимфоцитарной инфильтрации. Поскольку лимфоциты гетерогенны, оценка их гистохимических свойств с помощью иммунологических маркеров и моноклональных антител легла в основу иммунофенотипирования. Этот анализ имеет большое диагностическое значение в современной дерматологии.
Симптомы лимфоцитарной инфильтрации
Первичным элементом кожной сыпи при лимфоцитарной инфильтрации Джесснера-Канофа является крупная плоская розово-синюшная бляшка или папула с чёткими границами и гладкой поверхностью, имеющая тенденцию к периферическому росту. Сливаясь между собой, первичные элементы образуют кольцевидные или дугообразные «острова» с участками шелушения. Разрешение высыпавших элементов начинается с центра, поэтому сливные очаги могут иметь западание в центральной части. Типичной локализацией принято считать лицо, шею, околоушное пространство, затылок, лоб, щёки и скулы. Редко высыпания появляются на коже туловища и конечностях. Обычно первичный элемент одиночный, реже наблюдается тенденция к распространению процесса.
Лимфоцитарная инфильтрация Джесснера-Канофа характеризуется волнообразным рецидивирующим течением. Резистентна к проводимой терапии, способна спонтанно саморазрешаться. Рецидивы обычно возникают в местах прежней локализации, но могут захватывать и новые участки кожного покрова. Несмотря на длительное хроническое течение, внутренние органы в процесс не вовлекаются.
Диагностика лимфоцитарной инфильтрации
Заболевание диагностируется дерматологом на основании анамнеза, клиники, гистологии и люминесцентного микроскопирования (типичное свечение на границе дермоэпидермального соединения не определяется) с обязательной консультацией иммунолога и онколога. Гистологически при лимфоцитарной инфильтрации Джесснера-Канофа выявляется неизменённый поверхностный слой кожи. В толще дермальных слоёв обнаруживается группирование лимфоцитов и клеток соединительной ткани вокруг сосудов.
В сложных случаях проводят иммунотипирование опухоли, гистохимическое и молекулярное тестирование. К. Фан с соавторами рекомендуют основывать диагностику на результатах ДНК-цитофлюориметрии с анализом количества нормальных клеток (при лимфоцитарной инфильтрации Джесснера-Канофа более 97%). Дифференциальную диагностику проводят с саркоидозом, системной красной волчанкой, центробежной эритемой Биетта, кольцевидной гранулёмой, группой лимфоцитарных опухолей, токсикодермией и сифилисом.
Лечение лимфоцитарной инфильтрации
Лечение направлено на купирование острой фазы лимфоцитарной инфильтрации Джесснера-Канофа и увеличение продолжительности светлых промежутков. Терапия патологии неспецифическая. Отмечается хороший терапевтический эффект при назначении антималярийных препаратов (хлорохин, гидроксихлорохин) и нестероидных противовоспалительных средств (диклофенак, индометацин) после предварительного лечения сопутствующей патологии желудочно-кишечного тракта. Если состояние пищеварительной системы позволяет, применяют энтеросорбенты. Местно показаны гормональные кортикостероидные мази и кремы, а также инъекционные блокады очагов высыпаний триамцинолоном и бетаметазоном. При резистентности к проводимой терапии подключают плазмаферез (до 10 сеансов).
Хронический эндометрит — проблема и решения
Рассмотрены факторы риска развития хронического эндометрита, клинические симптомы заболевания, методы диагностики и подходы к комплексной терапии.
An examination was performed on the factors of the risk of the development of chronic endometritis, clinical symptoms of disease, methods of diagnostics and approaches to complex therapy.
.jpg)
В настоящее время актуальность проблемы ХЭ приобретает не только медицинское, но и социальное значение, поскольку данное заболевание часто приводит к нарушению репродуктивной функции, являясь причиной бесплодия, неудачных попыток экстракорпорального оплодотворения (ЭКО), невынашивания беременности (НБ), осложненного течения беременности и родов [1].
Хронический эндометрит — клинико-морфологический синдром, характеризующийся комплексом морфофункциональных изменений эндометрия воспалительного генеза, приводящих к нарушению нормальной циклической трансформации и рецептивности ткани.
Среди пациенток с ХЭ 97,6% составляют женщины репродуктивного периода, что подчеркивает особую значимость данной патологии с точки зрения влияния на репродуктивную функцию [2].
У женщин с бесплодием ХЭ встречается в 12–68% случаев, достигая своего максимума при наличии трубно-перитонеального фактора бесплодия. У больных с неудачными попытками ЭКО и переноса эмбрионов (ПЭ) частота ХЭ возрастает до 60% и более. Наибольшие показатели распространенности ХЭ отмечены у больных с привычным невынашиванием беременности и составляют более 70% [5, 6].
По данным различных авторов, факторами риска развития ХЭ являются все инвазивные вмешательства в полости матки (гистероскопия, выскабливание полости матки, биопсия эндометрия, гистеросальпингография, манипуляции в программах вспомогательных репродуктивных технологий и др.), инфекционно-воспалительные осложнения после беременностей и родов, использование внутриматочных спиралей (ВМС), инфекции влагалища и шейки матки, бактериальный вагиноз, деформации полости матки с нарушением циклического отторжения эндометрия, лучевая терапия в области органов малого таза [1, 7, 8].
В современных условиях эндометрит характеризуется рядом особенностей: изменением этиологической структуры с увеличением значимости вирусной и условно-патогенной флоры, ростом резистентности флоры к фармакотерапии, трансформацией клинической симптоматики в сторону стертых форм и атипичного течения, длительными сроками терапии и высокой ее стоимостью [9]. Современная общепризнанная классификация ХЭ, выстроенная по этиологическому фактору, претерпела в последнее десятилетие значительные изменения в сторону расширения перечня специфических форм заболевания. Существуют вирусные (вирус папилломы человека — ВПЧ, цитомегаловирус, вирус иммунодефицита человека), хламидийные, микоплазменные, грибковые, протозойные и паразитарные специфические эндометриты, отдельно выделен саркоидоз эндометрия [1, 10]. Для идентификации инфекционного агента обязательно проводить тщательное микробиологическое исследование соскоба эндометрия с определением чувствительности флоры к антибактериальным препаратам. В одной трети случаев при гистологически верифицированном ХЭ выявляются стерильные посевы эндометрия, что может свидетельствовать о важной роли условно-патогенной флоры в развитии воспалительного процесса или недостаточной детекции возбудителя, особенно в случае вирусной инвазии [11]. Длительная и часто бессимптомная персистенция инфекционных агентов в эндометрии приводит к выраженным изменениям в структуре ткани, препятствуя нормальной имплантации и плацентации, формируя патологический ответ на беременность, а также вызывает нарушение пролиферации и нормальной циклической трансформации ткани [12]. По различным данным, у больных с бесплодием частота ХЭ составляет в среднем 10% (от 7,8 до 15,4%). Среди женщин с верифицированным ХЭ в 60% случаев диагностируется бесплодие (в 22,1% — первичное бесплодие, в 36,5% — вторичное бесплодие), неудачные попытки ЭКО и переноса эмбрионов в анамнезе отмечены у 40% женщин [4, 12]. Клиническая картина ХЭ в значительной степени отражает глубину структурных и функциональных изменений в ткани эндометрия. Неполноценная циклическая трансформация эндометрия на фоне воспалительного процесса, нарушение процессов десквамации и регенерации функционального слоя эндометрия приводят к появлению основного симптома заболевания — маточных кровотечений (перименструальные, межменструальные). Достаточно постоянными являются жалобы на тянущие боли внизу живота, дисменорею и диспареунию, нередко отмечаются серозные и серозно-гноевидные бели. Среди клинических симптомов особое место занимает бесплодие (преимущественно вторичное), неудачные попытки ЭКО и НБ. Более половины пациенток в анамнезе имеют инвазивные вмешательства в полости матки и на органах малого таза. Часто хронический эндометрит сочетается с хроническим сальпингоофоритом и спаечным процессом в малом тазе. Важно отметить, что использование минимальных критериев для диагностики воспалительных заболеваний органов малого таза (ВЗОМТ), предложенных CDC (Centers for Disease Control and Prevention, США, 1993), информативно в случае с хроническим эндометритом только в 33% [7]. В целом у 35–40% пациенток какие-либо клинические симптомы заболевания отсутствуют [8, 13]. Диагностика ХЭ основана на анализе клинических симптомов, данных анамнеза, эхографической картины [2, 11]. Обязательным этапом диагностики заболевания является морфологическое исследование эндометрия [14].
Эхографические критерии ХЭ впервые разработаны профессором В. Н. Демидовым с соавт. (1993 г.). Исследование проводят дважды на 5–7 и 17–21 день менструального цикла. Часто при ХЭ полость матки после менструации расширена до 0,4–0,7 см, в ряде случаев имеется асимметричность расширения полости матки и неровность внутренней поверхности эндометрия. Изменение структуры эндометрия также выражается в возникновении в зоне срединного М-эха участков повышенной эхогенности различной величины и формы. Внутри участков выявляются отдельные зоны неправильной формы и сниженной эхогенности. Другой важный признак — наличие пузырьков газа, иногда с характерным акустическим эффектом «хвоста кометы». В базальном слое эндометрия часто визуализируются четкие гиперэхогенные образования диаметром до 0,1–0,2 см, представляющие собой очаги фиброза, склероза или кальциноза. Довольно редким, но важным признаком эндометрита является асимметрия толщины передней и задней стенок эндометрия. О наличии патологии свидетельствует также истончение М-эха во второй трети менструального цикла менее 0,6 см. У каждой пятой больной отмечается наличие нескольких из перечисленных признаков [15].
В настоящее время для диагностики внутриматочной патологии широко используется гистероскопия [16]. Наиболее частыми признаками воспалительного процесса в эндометрии являются: неравномерная толщина эндометрия — 30% случаев, полиповидные нарастания — 32,2%, неравномерная окраска и гиперемия слизистой оболочки — 23% и 11,8%, точечные кровоизлияния — 9%, очаговая гипертрофия слизистой оболочки — 7%. Трудности гистероскопической интерпретации данных связаны с отсутствием типичных макроскопических признаков хронического эндометрита, с очаговым характером воспалительного процесса и стертыми формами заболевания [17]. По разным данным гистероскопия позволяет по макроскопическим признакам точно идентифицировать хронический эндометрит только в 16–35% случаев [7, 16]. При подозрении на ХЭ гистероскопия важна для исключения всего спектра внутриматочной патологии, но для верификации диагноза во всех случаях необходимо проведение морфологического исследования эндометрия [8].
«Золотым стандартом» диагностики ХЭ является морфологическое исследование эндометрия, которое должно быть обязательным звеном алгоритма обследования [7, 13]. Диагностическое выскабливание слизистой оболочки матки производят в среднюю и позднюю фазу пролиферации, на 7–10 день менструального цикла. В последние годы общепринятыми критериями морфологической диагностики ХЭ являются [1]:
Несмотря на значительное развитие фармакологической основы терапии, лечение ХЭ в настоящее время представляет значительные трудности для клиницистов [4].
Комплексная терапия ХЭ должна быть этиологически и патогенетически обоснованной, поэтапной и базироваться на результатах максимально тщательного обследования [5]. Алгоритм лечения должен учитывать все звенья патогенеза заболевания.
Необходимость использования этиотропных препаратов для элиминирования повреждающего агента или снижение вирусной активности не вызывает сомнения. Принимая во внимание, что почти в 70% случаев ВЗОМТ применение рутинных методов диагностики не позволяет выявить этиологический фактор, эмпирическая антимикробная терапия при ХЭ всегда оправдана и приводит к достоверному уменьшению частоты клинических симптомов. При этом она должна обеспечивать элиминацию широкого спектра возможных патогенных микроорганизмов, включая хламидии, гонококки, трихомонады, грамотрицательные факультативные бактерии, анаэробы, стрептококки и вирусы. Оправдано назначение нескольких курсов этиотропной терапии со сменой групп препаратов [5, 18].
Выбор группы лекарственных препаратов зависит от данных микробиологического исследования содержимого влагалища и полости матки, анамнестических указаний на использование антибактериальных препаратов в течение последнего года, от выраженности клинической симптоматики и обширности воспалительного процесса [16].
Основу базовой антибактериальной терапии должны составлять комбинации фторхинолонов и нитроимидазолов; цефалоспоринов III поколения, макролидов и нитроимидазолов, а также сочетание защищенных пенициллинов (амоксициллин/клавулановая кислота) с макролидами. При наличии вирусной инфекции (чаще вируса простого герпеса) в зависимости от клинической картины применяют современные аналоги нуклеозидов (Ацикловир или Валтрекс), как правило, в длительном режиме — в течение не менее 3–4 месяцев [3, 19].
Одновременно на основании данных иммунного и интерферонового статуса проводится коррекция иммунных нарушений [20].
Второй этап лечения ХЭ направлен на восстановление морфофункционального потенциала ткани и устранение последствий вторичных повреждений: коррекция метаболических нарушений и последствий ишемии, восстановление гемодинамики и активности рецепторного аппарата эндометрия. Данный этап лечения крайне важен, должен быть продуманным и достаточно продолжительным [11].
Метаболическая терапия при ХЭ направлена на усиление тканевого обмена, активацию энергетических процессов в клетках, устранение последствий гипоксии ткани, в том числе угнетение анаэробного гликолиза [4, 12]. С этой целью используются комплексные метаболические препараты, длительность приема которых должна составлять не менее 3–4 недель. Представителем данной группы препаратов является Актовегин, полученный посредством диализа и ультрафильтрации, в состав которого входят низкомолекулярные пептиды и дериваты нуклеиновых кислот. Актовегин активирует клеточный метаболизм путем увеличения транспорта, накопления и усиления внутриклеточной утилизации глюкозы и кислорода, что приводит к ускорению метаболизма аденозинтрифосфата (АТФ) и повышению энергетических ресурсов клетки. Актовегин удобен для приема. Его выпускают и в таблетках, и в растворе для инъекций. Поэтому женщины, которые по каким-либо причинам не могут лечь в стационар или систематически приезжать на прием, принимают его дома по схеме, расписанной врачом. Актовегин таблетки принимают, не разжевывая, перед едой, запивая небольшим количеством жидкости, по 1 таблетке 2 раза в день в течение 30 дней [21]. При введении в форме инфузии к 200–300 мл основного раствора (0,9% раствор хлорида натрия или 5% раствор декстрозы) добавляют 10–20 мл Актовегина, раствор используют по следующей схеме: внутривенно через день в течение не менее двух недель. Скорость введения: около 2 мл/мин [22].
Положительное влияние Актовегина на кровообращение связано с улучшением доставки и утилизации кислорода, увеличением перфузии глюкозы и восстановлением аэробного метаболизма как в периферических тканях, так и в нейрональных структурах. Путем активации фермента супероксиддисмутазы препарат оказывает выраженное антиоксидантное и противоишемическое действие. Актовегин хорошо сочетается с другими лекарственными средствами, что очень удобно для комплексного лечения хронического эндометрита.
Традиционно в комплексной терапии ХЭ применяются физические факторы. Наиболее часто в комплексной терапии ХЭ применяют электроимпульсную терапию, интерференционные токи, переменное магнитное поле низкой частоты, ток надтональной частоты. Задачи физиотерапии при ХЭ заключаются в улучшении гемодинамики органов малого таза, стимуляции функции рецепторов, ускорении процессов регенерации эндометрия, повышении иммунологических свойств [4].
Дискуссионными остаются вопросы о целесообразности использования в комплексном лечении ХЭ циклической гормональной терапии. В настоящее время считается, что при хроническом эндометрите оправдано только дифференцированное назначение гормонотерапии при наличии гипофункции яичников или ановуляции. Потенциал к патологической регенерации ткани, который таит в себе хроническое воспаление, при назначении циклической заместительной гормональной терапии может быть усилен и реализован [3, 8].
Контроль эффективности терапевтических мероприятий должен проводиться не ранее чем через 2 месяца после окончания лечения с учетом эффекта последействия физиотерапии [2, 5]. При этом оценивается динамика клинических симптомов, проводится ультразвуковое исследование матки (допплерометрия сосудов матки) и аспирационная биопсия эндометрия (на 7–10 день менструального цикла) с последующим морфологическим исследованием эндометрия [1, 11].
Литература
А. З. Хашукоева, доктор медицинских наук, профессор
Н. Д. Водяник, кандидат медицинских наук, доцент
С. А. Хлынова, кандидат медицинских наук
Е. А. Цомаева
ГБОУ ВПО РНИМУ им. Н. И. Пирогова Минздравсоцразвития России, Москва
Лимфоцитарная инфильтрация стромы что это
Хронический аутоиммунный тиреоидит (АИТ) – классическое органоспецифическое аутоиммунное заболевание с образованием аутоантител, основным морфологическим проявлением которого является лимфоидная инфильтрация ткани щитовидной железы [3, 10]. Прошло уже около ста лет со дня первого описания аутоиммунного тиреоидита, однако и сегодня морфологическая диагностика аутоиммунных заболеваний щитовидной железы, в частности тиреоидита Хашимото, до сих пор является сложной задачей из-за многообразия гистологических форм [5, 9]. Многие авторы выделяют очаговый тиреоидит как форму аутоиммунного тиреоидита, относя его к ранней стадии заболевания, другие авторы выделяют очаговый тиреоидит как иммунную реакцию организма на различные патологические процессы щитовидной железы, не имеющие связь с аутоиммунным тиреоидитом [6, 7]. Имеются противоречивые данные по поводу гиперплазии тиреоидного эпителия в В-клетки. По данным одних авторов при очаговом тиреоидите в области лимфоплазмоцитарной инфильтрации тиреоидный эпителий имеет характерный вид и состоит из В-клеток, а по данным других, очаговый тиреоидит характеризуется отсутствием В-клеток [1, 7, 8]. В связи с противоречивыми данными возрастает важность изучения характера клеточной инфильтрации (2). На сегодняшний день имеется большое количество научных статей, посвященных морфологическому изучению щитовидной железы при АИТ, однако сведения о клеточном составе лимфоидной инфильтрации весьма скудные [4].
Цель исследования – изучение состава клеток лимфоидного инфильтрата при аутоиммунном и очаговом тиреоидите.
Материал и методы исследования
Исследование выполнено на основе изучения историй болезни и операционного материала, полученного от 72 больных с гистологически верифицированным диагнозом АИТ и 54 больных с очаговым тиреоидитом на фоне различных патологий щитовидной железы, прооперированных в городских больницах г. Ставрополя в период с 2009 по 2011 г.
Для гистологического и гистохимического исследования материал фиксировали в 10 % нейтральном формалине, заливали парафином и готовили срезы толщиной 5–6 мкм. Гистологические срезы гематоксилином и эозином для общих обзорных целей, по Ван Гизону, по Маллори в модификации Гейденгайна. Результаты выраженности того или иного признака оценивались полуколичественным методом, предложенным О.К. Хмельницким, по следующим критериям: 0 – отсутствует, (+) – слабая степень, (++) – умеренная степень, (+++) – выраженная реакция. Также проводили иммуногистохимические окраски всех срезов с использованием антител к CD4 (Т-хелперам), CD8 (Т-супрессорам) и B-лимфоцитам CD19. Для этого приготавливали парафиновые срезы толщиной 5 мкм, наклеивали на стекла, обработанные яичным альбумином. Затем срезы высушивали не менее суток при температуре 37 °С, подвергали депарафинизации и обезвоживанию, демаскировке антигенов (нагреванием на водяной бане до 95–99 °С) и непосредственно окрашиванию антителами. Для интерпретации результатов учитывали локализацию иммунореактантов и интенсивность их окрашивания, которую оценивали полуколичественным методом по следующим критериям: 0 – отсутствует, (+) – слабая реакция, (++) – умеренная реакция, (+++) – выраженная реакция. Морфометрический анализ проводился на микроскопе Nicon Eclipse E200 с цифровой камерой Nicon DS-Fil, персональном компьютере с установленным программным обеспечением NIS-Elements F 3.2.
Результаты исследования и их обсуждение
Макроскопически щитовидная железа при аутоиммунном тиреоидите нередко кремового цвета, плотная, бугристая, неравномерно дольчатая, зачастую спаяна с окружающими тканями, режется с трудом. Поверхность разреза беловато-желтая, непрозрачная, множество белесоватых втянутых тяжей разделяет ткань на мелкие неравные дольки, выступающие над поверхностью. Масса щитовидной железы варьировала от 15 до 38 грамм.
При очаговом тиреоидите щитовидная железа имела кремовый цвет, дольчатое строение, эластическую консистенцию, не спаянную с окружающими тканями, масса щитовидной железы варьировала от 23 до 29 грамм.
При гистологическом исследовании щитовидных желез с аутоиммунным тиреоидитом было выявлена различная степень выраженности инфильтрации. В 18 случаях площадь лимфоплазмоцитарной инфильтрации занимала 20 до 40 %, при этом инфильтрат образовывал лимфоидные фолликулы без четких границ и центров размножения. От 40 до 60 % в 41 случае в инфильтрате определялись крупные фолликулы с центрами размножения в них. В тканях щитовидных желез, содержащих более 60 % лимфоплазмоцитарной инфильтрации (13 случаев), помимо крупных фолликулов с центрами размножения, наблюдался более выраженный фиброз стромы.
Лимфоплазмоцитарные инфильтраты располагались как в строме, так и в паренхиме щитовидной железы. Вблизи инфильтратов определялась деструкция тиреоидного эпителия и более выраженная гиперплазия В-клеток. В двух случах (3 %) железы среди лимфоплазмоцитарной инфильтрации наблюдались отдельные участки эпидермоидной метаплазии фолликулярного эпителия.
При иммуногистохимическом исследовании определялась слабая (+) или умерено выраженная экспрессия (++) CD4 на Т-хелперах. Количество иммунопозитивных клеток лимфоидного инфильтрата варьировало от 8 до 15 % в одном поле зрения. При окраске CD8 во всех случаях выявлялась их выраженная экспрессия на Т-хелперах (+++), а количество иммунопозитивных клеток в инфильтрате варьировало от 31 до 47 %. CD19 экспрессировалась в цитоплазме B-лимфоцитов, при этом отмечалась выраженная (+++) степень экспрессии, а количество иммунопозитивных клеток в инфильтрате варьировало от 38 до 53 %.
При гистологическом исследовании материала с наличием очагового тиреоидита участки лимфоидной инфильтрации определялись преимущественно в строме щитовидной железы. При этом ни в одном из 54 случаев скопления лимфоидной ткани не образовывали фолликулов с центрами размножения. Во всех случаях площадь, занимаемая инфильтратом, не превышала 10 %. При иммуногистохимическом исследовании выявлена в равной степени выраженная (+++) экспрессия CD4 на Т-хелперах и CD8 на Т-супрессорах. При подсчете СD4 иммунопозитивных клеток выявлено от 35 до 57 % клеток в поле зрения. Количество CD8 иммунопозитивных клеток варьировало от 44 до 56 %. Отмечалось отсутствие экспрессии либо слабая (+) экспрессия CD19 на B-лимфоцитах, соответственно количество иммунопозитивных клеток инфильтрата от 0 до 5 % в поле зрения. Среди лимфоплазмоцитарной инфильтрации при очаговом тиреоидите участки эпидермоидной метаплазии тиреоидного эпителия не наблюдались.
Выводы
Лимфоплазмоцитарная инфильтрация при аутоиммунном тиреоидите занимает значительную площадь тиреоидного эпителия, располагается как в строме, так и в паренхиме ткани щитовидной железы. Лимфоидный инфильтрат включает в себя в равной степени В и Т-лимфоциты, однако среди Т-лимфоцитов отмечается увеличение количества Т-хелперов над Т-супрессорами.
В отличие от аутоиммунного тиреоидита, очаговый тиреоидит имеет следующие особенности.
Исходя из вышеуказанных оссобенностей нет оснований рассматривать очаговый тиреоидит как раннюю стадию аутоиммунного тиреоидита.
Рецензенты:
Коробкеев А.А., д.м.н., профессор, заведующий кафедрой нормальной анатомии, ГБОУ ВПО «Ставропольский государственный медицинский университет» Министерства здравоохранения РФ, г. Ставрополь;
Чуков С.З., д.м.н., профессор кафедры патологической анатомии, ГБОУ ВПО «Ставропольский государственный медицинский университет» Министерства здравоохранения РФ, г. Ставрополь.