Лимфоузлы не дифференцируются что это
Эхография в дифференциальной диагностике поражения лимфатических узлов опухолевого и неопухолевого генеза
УЗИ аппарат RS85
Революционные изменения в экспертной диагностике. Безупречное качество изображения, молниеносная скорость работы, новое поколение технологий визуализации и количественного анализа данных УЗ-сканирования.
Одним из нередких состояний, приводящих ребенка к врачу, является увеличение лимфатических узлов. Увеличение лимфатических узлов, связанное с лимфопролиферативным процессом (острый лимфобластный лейкоз, неходжкинские лимфомы, лимфомы Ходжкина, гистиоцитозы, метастазы солидных опухолей), встречается в 1% случаев. В остальных 99% случаев причиной увеличения лимфатических узлов являются остро и хронически протекающие инфекции [1]. Ситуация с увеличением лимфатических узлов становится напряженной, если знать, что в детской практике имеются медленно растущие опухоли (несколько месяцев), например лимфомы Ходжкина, и быстро, агрессивно растущие опухоли (несколько дней, недель), например неходжкинские лимфомы. Врач-педиатр должен быстро оценить ситуацию и понять, по какому пути пойти: диагностика инфекций и антибактериальная терапия или исключение лимфопролиферативного процесса.
После сбора анамнеза в процессе первичного осмотра ведущим приемом обследования таких пациентов является пальпация. Диагностическая точность пальпаторного исследования не превышает 50-60% [2, 3].
В плане дифференциальной диагностики дополнительными критерями могут служить результаты ультразвуковых исследований. УЗИ рассматривается как наиболее распространенный неинвазивный метод исследования первого уровня [4, 5]. Имеется много исследований, посвященных возможностям УЗИ в дифференциальной диагностике воспалительных и злокачественных процессов в лимфатических узлах [6, 7]. Однако основная масса публикаций построена как описательные работы и не содержит математически доказанных диагностических критериев. Целью данного исследования явилось повышение качества дифференциальной диагностики опухолевого и воспалительного поражения лимфатических узлов по итогам проведения УЗИ.
Материал и методы
Медиана возраста детей 2-й группы составляла 12,3 года (пределы колебаний 8-16 лет). Причиной лимфаденитов были цитомегаловирусная (5 детей), хламидиозная (семеро) инфекции, боррелиоз (один). В остальных 37 (74%) наблюдениях выявить достоверный инфекционный фактор не удалось, но после назначения антибиотиков цефалоспориновой группы через 14-20 дней наступило улучшение, что косвенно свидетельствовало о бактериальном генезе лимфаденита.
УЗИ выполняли на современном ультразвуковом сканере. Обследовали подмышечные, шейные, паховые, внутриполостные лимфатические узлы. Качественные характеристики лимфатических узлов включали эхоплотность, однородность или неоднородность внутренней структуры, характер краев (ровные, полицикличные). Линейные размеры лимфатических узлов определяли в миллиметрах. Так как лимфатический узел в норме имеет бобовидную форму, выделяли максимальный размер (длинник) и минимальный (его поперечник). Результаты обрабатывали математически с определением средней величины, медианы, пределов колебания. Статистическую значимость различий оценивали по Манн-Уитни, Фишеру и критерию χ² Пирсона.
Лимфоузлы не дифференцируются что это
Роль эхографии в дифференциальной диагностике доброкачественных и злокачественных лимфаденопатий.
Аббасова Е.В Пархоменко Р.А. Щербенко О.И.. Родионов М.В.
Лаборатория детской рентгенорадиологии РНЦРР, Москва
Адрес документа для ссылки: h ttp://vestnik.rncrr.ru/vestnik/v4/papers/ abbas_v4. htm
Проблема дифференциальной диагностики лимфаденопатий (ЛАП), в том числе у детей, является весьма актуальной, но она еще далека от разрешения. Актуальность данной темы исследования обусловлена многообразием нозологий, сопровождающихся лимфопролиферативным синдромом, а так же сложностью дифференциальной диагностики доброкачественных и злокачественных ЛАП. Биопсия лимфатического узла (ЛУ) была и остается завершающим этапом дифференциальной диагностики злокачественных и доброкачественных ЛАП, но показания к ее своевременному выполнению не определены и устанавливаются или эмпирически или при развернутой клинической картине заболевания (1, 2, 3, 7, 8).
Вместе с тем, за последнее десятилетие достигнут значительный прогресс в методах визуализации. Среди них ведущим, несомненно, является эхография. Повышение разрешающей способности эхографии в В-режиме позволило визуализировать ранее недоступные исследованию структуры. Так, если в недалеком прошлом удавалось оценить лишь размеры и общую эхогенность ЛУ, то в настоящее время появилась возможность детально исследовать их структуру, состояние ангиоархитектоники и другие, ранее недоступные параметры. [9, 10].
Однако, эхография в В-режиме на сегодняшний день не позволяет уверенно говорить о злокачественности. В связи с этим очевидны усилия по совершенствованию ультразвуковой аппаратуры и поиску новых ультразвуковых признаков, или набора признаков, которые позволили бы повысить показатели специфичности ультразвукового метода и тем самым сузить показания к биопсии ЛУ.
Несмотря на то, что эхография не может поставить гистологического диагноза, на основании ряда эхографических критериев, отображающих структуру ЛУ, определяются дальнейшие диагностические и терапевтические процедуры. Очевидно, что успехи лечения и прогноз заболевания, прежде всего, зависят от раннего выявления и своевременно начатой терапии [6].
На основании вышеизложенного нам представляется актуальным научное исследование по совершенствованию эхографического метода, в том числе определение места и роли новейших ультразвуковых технологий в дифференциальной диагностике лимфопролиферативного синдрома.
Материалы и методы
Общая характеристика наблюдавшихся больных.
Объектом анализа явились результаты комплексного обследования 241 пациента, у которых ультразвуковому исследованию (эхографии) подверглись 907 периферических ЛУ (табл. 1). Исследование проводилось с сентября 2000 года по сентябрь 2004 года. Возраст 174 обследованных пациентов (72 %) был менее 18 лет. Число лиц обоего пола было почти одинаковым: 121 женщина и 120 мужчин.
У 189 человек исследование проводилось в связи с наличием увеличенных ЛУ. В зависимости от окончательного диагноза данная группа была нами поделена на четыре подгруппы (см. также таблицу 1):
а) 109 больных имели реактивную лимфаденопатию неопухолевого генеза;
б) У 47 больных выявлены злокачественные опухоли системы гемопоэза;
в) У 17 человек имелись метастазы солидных новообразований в ЛУ;
г) У 16 человек выявлены различные, редко наблюдавшиеся в нашей практике заболевания.
Контрольная группа из 52 человек была представлена детьми и взрослыми без признаков периферической лимфаденопатии. В эту группу были включены школьники младших классов, обследованных в плане диспансеризации, а также дети и взрослые, обратившиеся за консультативной помощью в детское отделение РНЦ РР по поводу других заболеваний.
Кроме объективного исследования, анализу подвергались данные анамнеза жизни пациентов – такие, как особенности анте- и постнатального периода, в частности, указания на наличие у ребенка внутриутробной инфекции, хронической ЛОР-патологии, частоты и давности ОРВИ и других инфекционных заболеваний, контактов с инфекционными больными, туберкулезной инфицированности.
Таблица 1. Структура исследованных лимфаденопатий.
Болезнь кошачьей царапины
Острый лимфобластный лейкоз
Метастазы злокачественных опухолей
Метастазы солидных опухолей
Метастазы рака молочной железы
Метастазы рака головы и шеи
Общее количество узлов
Морфологическому исследованию было подвергнуто 253 ЛУ из 907 (28 %). Это было осуществлено путем эксцизионной биопсии 101 узлов с гистологическим и иммуногистохимическим (48 случаев) исследованием материала, трепанобиопсии с гистологическим исследованием материала из 4 ЛУ, цитологического исследования материала полученного путем тонкоигольной пункции 152 ЛУ, в том числе под контролем пальпации (83 узла) или под контролем ультразвукового исследования (69 узлов). Природа 651 увеличенных ЛУ у 82 больных устанавливалась на основании данных клинико-эхографического мониторинга, проводимого в сроки от 1 месяца до 1 года после первичного УЗИ, с учетом результатов лечения.
Обследование лимфатических коллекторов области головы и шеи производилось по общепринятой методике. Кроме того, впервые нами был использован дорзальный доступ, когда пациент располагался лежа на животе с максимальным сгибанием головы во фронтальной плоскости. При этом его подбородок максимально соприкасался с грудиной, а лоб упирался в кушетку. Такой способ, по нашим наблюдениям, позволял добиться максимальной фокусировки и улучшению визуализации эхоструктуры верхнешейных ЛУ.
В В-режиме оценивали распространенность поражения ЛУ по регионарным зонам, количество выявленных ЛУ, однотипность изменений эхоструктуры ЛУ. После этого проводился анализ изменений в каждом конкретном видимом эхографически ЛУ. При этом давалась оценка следующих параметров: линейные размеры максимального продольного и поперечного диаметра ЛУ; соотношение продольного и передне-заднего диаметров ЛУ (индекса Solbiati ); форма ЛУ (округлая, овоидная); возможность дифференциации составных частей ЛУ; толщина изображения сердцевины ЛУ (утолщена/истончена/не изменена)- обратно коррелирует с толщиной коры ЛУ; положение изображения сердцевины (обычное/смещено к периферии/деформировано); толщина коры ЛУ (истончена/утолщена/не изменена); общая эхогенность ЛУ (не изменена/снижена/повышена); эхоструктура ЛУ (не изменена/однородная/диффузно-неоднородная/наличие анэхогенных зон); наличие дополнительных гиперэхогенных включений в структуре ЛУ; состояние контуров ЛУ (четкие/нечеткие, ровные/бугристые); состояние окружающих тканей (не изменены/повышенной эхогенности/сниженной эхогенности).
Допплерография (Импульсноволновая допплерография, цветовое допплеровское картирование, энергетическое картирование (ЦД(Э)К) периферических ЛУ.
Для более полного исследования периферических ЛУ в 433 случаях из общего количества ЛУ (907), исследованных в В-режиме (48 %), мы применяли методики ультразвуковой ангиографии – Ц(Э)ДК. Из них в 353 случаях была выполнена импульсноволновая допплерография ( PW ) интранодальных сосудов с артериальным характером кровотока. P И в нашем исследовании проводилась по стандартной схеме исследования магистральных сосудов. В процессе исследования мы использовали линейный датчик с допплеровской частотой 7,5-10 МГц. Для исследования артерий и артериол области ворот использовалась стандартная шкала диапазона скоростей от 0 до 30,5 см/сек. При исследовании приводящих артериальных сосудов наблюдались следующие условия: проводилась корректировка положения датчика и направления допплеровской волны; допплеровский фильтр устанавливался на самые минимальные показатели.
Допплерографические признаки позволили оценить качественные характеристики васкуляризации: наличие или отсутствие интранодального кровотока, тип кровотока, тип интранодальной ангиоархитектоники. На основании обобщения данных литературы мы считаем целесообразным применить следующую классификацию типов сосудистой сети ЛУ по данным Ц(Э)ДК:
1) «хилусный тип», когда нам удалось визуализировать кровеносные сосуды в области ворот (хилуса) в виде единичных артериальных и /или венозных сосудистых фрагментов, без распространения в паренхиму узла и без ветвления;
2) «активированный хилусный тип», когда мы выявляли в той или иной мере хилусные сосуды и сосуды медуллярного слоя в виде «древовидных с ветвлением» венозных и артериальных сосудов (в литературе данный тип нередко обозначается как «центральный»);
3) «периферический тип» сосудистой внутринодальной сети соответствует сосудистым фрагментам локализованным по периферии ЛУ, в области коры ЛУ, преимущественно в подкапсульных отделах;
4) «смешанный кровоток» был представлен богатым кровоснабжением с цветовыми сигналами как в центре, так и по периферии узла. Мы выделили два варианта данного типа кровотока:
4а) в области ворот (хилуса) ЛУ располагается один крупный артериальный сосуд, по периферии единичные точечные цветовые сигналы фрагментов мелких сосудов;
Оценка достоверности различий полученных значений средней «М» и доли «Р» оценивалась с помощью критерия Student : « t » – доверительный коэффициент, уровень вероятности ошибки «р» в работе принят за 0,05, «Р»= 95%. Различия считались статистически достоверными при вероятности безошибочного прогноза р ≤ 0,05. Статистические показатели диагностических свойств параметров – информативность метода при уже определенных диагностических критериях, рассчитывалась по общепринятым формулам.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ.
Эхографические критерии периферических ЛУ в норме.
В анализируемой группе, в которой дети и подростки до 16 лет составляли 84%, при эхографии было выявлено 228 неизмененных периферических ЛУ.
При исследовании у большинства детей выявлялись мелкие ЛУ шейных, подмышечных и паховых групп. При этом 143 узла – (63% от общего количества неизмененных ЛУ) располагались в шейной области, а подмышечные и паховые составляли соответственно 53 (20%) и 37 (14%).
При исследовании аксиллярных и паховых областей дополнительно было выявлено 31 ЛУ (11,7% от нормальных ЛУ), которые имели эхографические признаки липоматоза. Такое изображение аксиллярных л/у было отмечено у женщин старшей возрастной категории после 35 лет и у подростков с нарушением жирового обмена. Остальные периферические ЛУ в контрольной группе пациентов не выявлялись, а их наличие расценивалось как патологическое.
Размеры выявленных неизмененных ЛУ в различных анатомических областях были разными, как и их форма: в наибольшем продольном диаметре от 4 до 27 мм (1,18±0,36 см )- и от 2 до 8 мм (0,468 ± 0,12) – в наименьшем поперечном диаметре. Большинство из них были непальпируемыми. Наиболее крупные ЛУ овальной формы были характерны для шейной зоны, очевидно, как зоны наибольшего антигенного раздражения, тогда как паховые и аксиллярные имели относительно меньшие размеры. Максимальный продольный диаметр югуло-дигастрального ЛУ Кютнера, расположенного в верхней трети шеи у взрослых и старших подростков, достигал 30 мм. Аксиллярные ЛУ встречались как овальной так и округлой формы, что, очевидно, связано с характером окружающих тканей и степенью их давления на ЛУ.
У детей ( 154 случая – младше 11 лет) наибольший продольный диаметр был достоверно меньше ( 1,10±0,31см), чем у взрослых( 49 случаев старше 16 лет- 1,34±0,47 см), р короткому диаметру было недостоверным в указанных возрастных группах, что, очевидно, связано с большей выраженностью лимфоидного компонента в ЛУ у детей в виде относительно боле толстого коркового слоя. Данное наблюдение подтверждается достоверной разницей индексов Solbiati у детей младше 11 лет и у лиц старше 16 лет. ЛУ в норме у детей были более округлой формы (индекс Solbiati детей 2,4± 0,05, у взрослых 2,9±0,125, p
Нами было изучено значение поперечного и продольного размеров ЛУ в констатации лимфаденопатии.
Диагноз ЛАП был правомочен, по нашим данным, при увеличении наименьшего поперечного диаметра шейных ЛУ у взрослых и подростков > 8 мм, у детей младшего школьного возраста >6 мм. Границей гиперплазии для паховых и аксиллярных ЛУ являлось значение передне-заднего диаметра у детей 5мм, у взрослых 8 мм соответственно. Увеличение размеров продольного диаметра по длинной оси лимфатического узла имело, по нашим данным, меньшее значение в постановке диагноза ЛАП.
В нижеследующей таблице представлены характерные признаки при некоторых группах ЛАП.
Таблица 2. Сравнительная характеристика эхографических признаков трех групп лимфаденопатий (ЛАП).
Метастатическое поражение шейных лимфатических узлов
Шейные лимфатические узлы являются частым местом метастазирования злокачественных опухолей, первичный очаг которых располагается в области головы и шеи. К ним, например, относятся плоскоклеточный рак верхних отделов дыхательных путей, а также метастазы рака слюнных желез и щитовидной железы.
Наиболее распространенным клиническим признаком является увеличивающееся образование шеи, которое обычно обнаруживается пациентом или его врачом. При подозрении на метастатическое поражения лимфатических узлов шеи для диагностики и определения наилучшей тактики лечения потребуется осмотр врачом-онкологом, инструментальные методы и биопсия.
Иногда новообразования вне области головы и шеи могут неожиданно метастазировать в шейные лимфатические узлы, что требует особенно тщательной диагностики для выявления первичного очага.
Лечение будет зависеть от типа и локализации первичной опухоли, которая распространилась в лимфатические узлы шеи, и, скорее всего, будет включать в себя комбинацию хирургического вмешательства, лучевой терапии и/или химиотерапии.
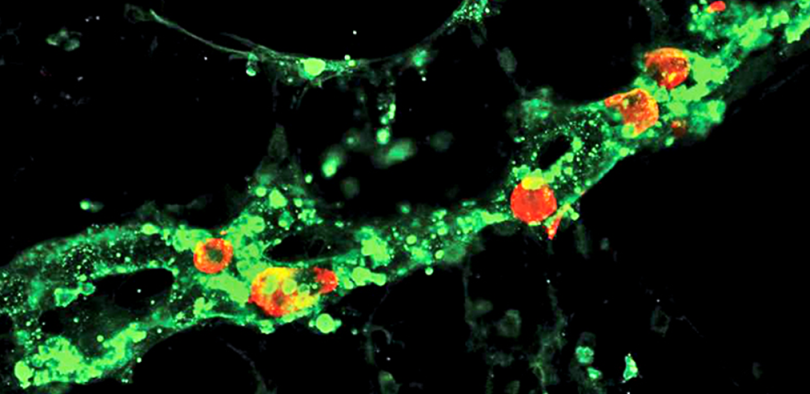
Иммунофлюоресцентная визуализация метастатических клеток меланомы (красные) внутри лимфатических сосудов (зеленые). Масштабная линейка: 100 мкм
(Science Advances/Michael Detmar Group ©)
Из чего состоит лимфатическая система шеи
Лимфатическая система шеи включает в себя сосуды и узлы.
Лимфатические капилляры — это тонкостенные структуры, состоящие из одного слоя эндотелиальных клеток. Они находятся во всех тканях организма и, объединяясь друг с другом, способствуют оттоку лимфатической жидкости в более крупные лимфатические сосуды.
Стенка лимфатических сосудов состоит из трех слоев: внутреннего слоя эндотелиальных клеток, среднего мышечного слоя и внешнего слоя соединительной ткани. В лимфатических сосудах гораздо больше клапанов, чем в венозных, при этом циркуляция лимфы полностью зависит от сжатия сосудов окружающими мышцами. Лимфатические сосуды дренируют лимфу в лимфатические узлы.
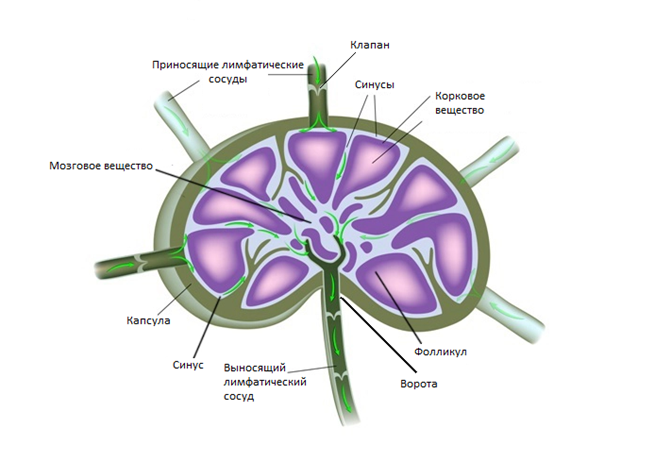
В среднем на каждой стороне шеи расположено до 75 лимфатических узлов. Снаружи узел покрывает капсула, под которой располагается субкапсулярные синусы – место куда попадает лимфатическая жидкость из приносящих лимфатических сосудов. Жидкость проходит сквозь ткань лимфатического узла, которая состоит из коркового и мозгового вещества, а затем выходит через ворота лимфатического узла и попадает в отводящие лимфатические сосуды. В итоге лимфа попадает в венозную систему в месте соустья внутренней яремной и подключичной вены.
Анатомическая структура лимфатического узла (Alila Medical Media/ Shutterstock ©)
Классификация лимфатических узлов шеи
На данный момент во всем мире рекомендована к использованию классификация Американского объединенного комитета по раку (American Joint Committee on Cancer (AJCC)) 8 издания от 2018 года:
Уровни лимфатических узлов шеи (Tenese Winslow LLC ©)
Диагностика
Осмотр
При пальпации шеи врач обращает внимание на расположение, размер, плотность и подвижность каждого узла. Особое внимание уделяется узлам, которые кажутся фиксированными к подлежащим сосудисто-нервным структурам и внутренним органам. Описание каждого узла становится важной частью медицинской документации, которая в дальнейшем может использоваться для оценки эффекта лечения.
Лучевые методы
Преимуществами УЗИ перед другими методами визуализации являются цена, скорость исследования и низкая лучевая нагрузка на пациента.
Ультразвуковыми признаками метастатического поражения лимфатических узлов может быть образование сферической формы, нарушение структуры, нечеткие границы, наличие центрального некроза и др.
Поскольку не всегда по УЗИ можно с уверенностью сказать является лимфатический узел пораженным или нет, иногда одновременно выполняют тонкоигольную аспирационную биопсию под ультразвуковым контролем с последующим цитологическим исследованием материала из этого узла. Результат цитологического исследования зависит от навыков врача УЗИ и качества образца (т.е. наличия достаточного количества репрезентативных клеток).
С появлением систем высокого разрешения и специальных контрастных веществ КТ позволяет обнаруживать лимфатические узлы, которые могли быть пропущены при иных методах диагностики.
Ценность МРТ – превосходная детализация мягких тканей. МРТ превосходит КТ в качестве предпочтительного исследования при оценке ряда новообразований головы и шеи, таких как основание языка и слюнные железы. Размер, наличие нескольких увеличенных узлов и центральный некроз – критерии, общие для протоколов исследования КТ и МРТ.
Этот новый метод визуализации все чаще используется для определения стадии опухолей головы и шеи. Метод основан на поглощении 2-фтор-2-дезокси-D-глюкозы (ФДГ) метаболически активными тканями. Исследование также может быть объединено с КТ, чтобы улучшить разрешение получаемого изображения и более точно определить расположение образования.
Биопсия
Биопсия — это удаление небольшого кусочка ткани для исследования под микроскопом или для тестирования в лаборатории на предмет наличия признаков злокачественности. В подавляющем большинстве случаев проводится тонкоигольная аспирационная биопсия. Врач, выполняющий биопсию, может использовать УЗИ или КТ для выполнения процедуры. Иногда тонкоигольная аспирационная биопсия не позволяет поставить окончательный диагноз, и требуются другие виды биопсии, такие как трепан-биопсия или эксцизионная биопсия.
 | 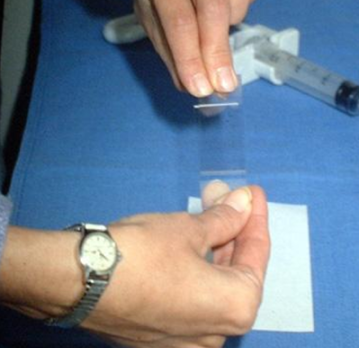 |
| Процесс приготовления предметных стекол для цитологического исследования. Материалом служит содержимое шприца после выполнения тонкоигольной аспирационной биопсии | |
План лечения
После определения диагноза и проведения всех диагностических исследований врач порекомендует оптимальный для пациента курс лечения. В конечном итоге лечение метастатического поражения лимфатических узлов зависит от типа и локализации первичной опухоли.
Существует три различных варианта лечения, которые могут быть использованы отдельно или в комбинации:
Хирургическое лечение
Хирургическое лечение обычно включает удаление лимфатических узлов шеи (лимфодиссекция) и последующее гистологическое исследование для точного определения стадии, так как это может существенно повлиять на дальнейшую тактику лечения. Хоть и не всегда, но чаще всего лимфодиссекция выполняется одновременно с удалением первичной опухоли.
Существуют различные виды лимфодиссекций:
Лучевая терапия
Лучевая терапия может быть назначена в качестве самостоятельного метода лечения в послеоперационном периоде, чтобы снизить вероятность рецидива либо в комбинации с химиотерапией в качестве самостоятельного или адъювантного лечения. Обычно адъювантная лучевая терапия необходима, если по результатам гистологического исследования обнаруживается несколько пораженных лимфатических узлов.
Химиотерапия
Химиотерапия обычно добавляется к лучевой терапии в качестве самостоятельного или адъювантного (послеоперационного) лечения. В некоторых случаях может использоваться индукционная химиотерапия с целью уменьшения объема образования и последующего хирургического вмешательства.
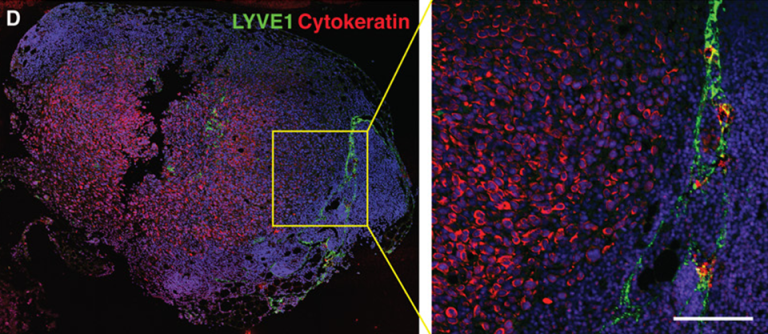
Иммунофлюоресцентная визуализация метастатически пораженного лимфатического узла с окраской на Цитокератин (красный) – маркер характерный для опухолевых клеток эпителиального происхождения. Масштабная линейка: 50 мкм
(Science Advances/Michael Detmar Group ©)
Прогноз
Метастазы в лимфатические узлы шеи могут возникать при онкологических заболеваниях различных локализаций, поэтому давать прогностические оценки для этой группы пациентов следует только после выявления первичной опухоли.
Факторы, влияющие на прогноз:
Наблюдение после лечения
Пациенты должны регулярно посещать своего специалиста по опухолям головы и шеи для оценки состояния на предмет любых признаков рецидива заболевания.
Стандартный график наблюдения
В первые 1–2 года осмотр и сбор жалоб рекомендуется проводить каждые 3–6 месяца, на сроке 3–5 лет – один раз в 6–12 месяцев. После 5 лет с момента операции посещать врача необходимо один раз в год или при появлении жалоб. У пациентов с высоким риском рецидива перерыв между обследованиями может быть сокращен.
Список литературы:
Авторская публикация:
Амиров Николай Сергеевич
Клинический ординатор НМИЦ онкологии им. Н.Н. Петрова
Под научной редакцией:
Раджабова З.А.
Заведующий отделением опухолей головы и шеи
НМИЦ онкологии им. Н.Н. Петрова,
врач-онколог, научный сотрудник, кандидат медицинских наук, доцент