Лимфоваскулярная инвазия что это такое в онкологии расшифровка
Лимфоваскулярная инвазия что это такое в онкологии расшифровка
хирург-онколог, маммолог, кандидат медицинских наук
Ленинградская область, Всеволожский район, пос.Кузьмоловский, Заозерная ул., 2
Врач в третьем поколении. Закончил в 1998 году с отличием Санкт-Петербургскую государственную медицинскую академию им. И.И. Мечникова, после чего сразу же поступил в клиническую ординатуру по хирургии этой же академии. Во время обучения в клинической ординатуре, которую с отличием закончил в 2000 году, получил специализацию по онкологии (1999). Начиная с 1999 года, обучение проводилось на базе Ленинградского областного онкологического диспансера (отделение общей онкологии). С 2000 по 2004 год проходил обучение в аспирантуре и в 2004 году защитил кандидатскую диссертацию на тему «Хирургическое и адъювантное лечение ранних форм рака молочной железы». Имею действительные сертификаты по хирургии (2021) и онкологии (2018), реконструктивной и пластической хирургии (2019). Являюсь лучшим маммологом Санкт-Петербурга 2016 года по версии сайта НаПоправку, лучшим маммологом Санкт-Петербурга в 2020 и 2021 годах по версии Prodoctorov.Ru
Лечу рак молочной железы по федеральным квотам в Клинической больнице Российской академии наук, принимаю и лечу пациентов в клинике онкологических решений ЛУЧ
С 2004 года являюсь главным исследователем и координатором международных клинических исследований по раку молочной железы в Ленинградском областном клиническом онкологическом диспансере, клинике онкологических решений ЛУЧ.
Имею более 10 печатных работ, в том числе в центральной зарубежной печати.
Рабочий телефон +7921 945 33 18
Мобильный телефон +7 921 945 33 18
Телефон администратора +7 981 710 40 41
Инвазивный рак шейки матки
Заболеваемость варьирует от 3,5 до 21 на 100000 женского населения. Частота этого вида рака в ряде развитых стран имеет тенденцию к снижению. В структуре заболеваемости генитальным раком рак шейки матки занимает третье место после рака тела матки и рака яичников.
Этиология. Причину развития рака шейки матки связывают с инфицированием HPV с высоким онкогенным риском (типы 16, 18, 45, 56).
Факторы риска. Раннее начало половой жизни, частая смена половых партнеров (в том числе и мужчиной-партнером), большое количество родов и абортов, травмы шейки матки, воспалительные болезни половых органов, и в том числе передающиеся половым путем, низкий социальный статус, курение, длительное применение оральных контрацептивов, вредные условия труда (на табачных, горнорудных, нефтеперерабатывающих производствах).
Патологическая анатомия. Патологический процесс может локализоваться на влагалищной части шейки матки либо в шеечном канале. Различают следующие формы роста опухоли: эндофитный (52%), экзофитный (32%), смешанный (16%).
Рак шейки матки возникает из многослойного плоского или цилиндрического эпителия желез шеечного канала. Гистологические типы опухоли: плоскоклеточный ороговевающий и неороговевающий рак (60-93%), аденокарцинома (3-25%), низкодифференцированный рак (5-10%), прочие эпителиальные опухоли.
Патологический процесс распространяется по протяжению и путем лимфогенного метастазирования. Характерно раннее возникновение метастазов в регионарных подвздошных лимфатических узлах; их частота при раке шейки матки I стадии составляет 10-25%, II — 25-45%, III стадии — 30-65%. Гематогенное метастазирование обнаруживается на поздних этапах развития опухолевого процесса (в кости, печень, кишечник, мозг, влагалище).
Классификация. Стадии FIGO опираются на клиническое стадирование, категории TNM — на клинические или патогистологические (pTNM) данные.
TNM FIGO, категории стадии
Т — первичная опухоль
Тх — недостаточно данных для оценки первичной опухоли,
Т0 — первичная опухоль не определяется,
Tis 0 преинвазивная карцинома (carcinoma in situ),
Т1 I рак шейки матки, ограниченный шейкой (распространение на тело матки не учитывается):
T1a IA инвазивная опухоль диагностируется только микроскопически. Все макроскопически определяемые поражения (даже при поверхностной инвазии) обозначаются как T1b/IB:
T1a1 IA1 стромальная инвазия до 3 мм (включительно) в глубину и до 7 мм (включительно) по горизонтальному распространению
T1a2 IA2 стромальная инвазия более 3 мм и до 5 мм (включительно) в глубину и до 7 мм (включительно) по горизонтальному распространению,
T1b IB клинически определяемый очаг поражения, ограниченный шейкой матки, или микроскопически определяемое поражение большего размера, чем Т1а2/1А2:
T1b1 IB1 клинически определяемый очаг поражения до 4 см (включительно) в наибольшем измерении,
T1b2 IB2 клинически определяемый очаг поражения более 4 см в наибольшем измерении,
Т2 II опухоль шейки матки с распространением за пределы матки, но без прорастания стенки таза или нижней трети влагалища:
T2a IIA без инвазии параметрия,
Т2b IIВ с инвазией параметрия,
ТЗ III рак шейки матки с распространением на стенку таза, и/или поражением нижней трети влагалища, и/или вызывающий гидронефроз и нефункционирующую почку,
ТЗа IIIA опухоль поражает нижнюю треть влагалища, но не распространяется на стенку таза,
ТЗb IIB опухоль распространяется на стенку таза и/или приводит к гидронефрозу и нефункционирующей почке,
Т4 IVА опухоль распространяется на слизистую оболочку мочевого пузыря или прямой кишки и/или выходит за пределы малого таза. Наличия буллезного отека недостаточно для классифицирования опухоли как Т4.
N — регионарные лимфатические узлы. Регионарными лимфатическими узлами являются: парацервикальные, параметраль-ные, обтураторные, подчревные (внутренние подвздошные), наружные подвздошные, общие подвздошные, пресакральные, латеральные сакральные.
Nx — недостаточно данных для оценки состояния регионарных лимфатических узлов, N0 — нет признаков метастатического поражения регионарных лимфатических узлов, N1 III имеется поражение регионарных лимфатических узлов метастазами.
М — отдаленные метастазы:
Мх — недостаточно данных для определения отдаленных метастазов,
М0 — нет признаков отдаленных метастазов,
M1 IVB имеются отдаленные метастазы.
pTNM — патогистологическая классификация
Требования к определению категорий рТ и pN соответствуют требованиям к определению категорий Т и N. pN0 — гистологическое исследование тазовых лимфатических узлов обычно включает 10 и более узлов.
Клиника. Основные симптомы рака шейки матки — бели, кровотечения и боли, которые появляются преимущественно при распространенном процессе. Кровотечения бывают разной интенсивности — от контактных до профузных. Боли локализуются внизу живота, в пояснично-крестцовой области, могут иррадиировать в нижние конечности, беспокоят в покое. Характерно вовлечение в патологический процесс органов мочевыделительной системы, что обусловливает дизурию и, реже, уремию. Возможны отек нижних конечностей и возникновение нефункционирующей почки.
На начальном этапе развития опухоль визуально представлена небольшими участками изъязвления слизистой оболочки, сосочковыми разрастаниями или синюшностью и уплотнением шейки матки. По мере роста опухоли определяются экзофитные разрастания с явлениями некроза или кратерообразные язвы на месте разрушенной шейки матки; при эндоцервикальном росте рака характерна «каменная» плотность органа и формирование «бочкообразной» шейки матки. Подвижность последней уменьшается.
Диагностика. Распознавание инвазивного рака шейки матки основывается на данных анамнеза, осмотра шейки матки с помощью ложкообразного зеркала и подъемника, ректовагинального гинекологического исследования, зондирования полости матки, кольпоскопии, гистероцервикоскопии, гистероцервикографии, цитологического и гистологического изучения материала с влагалищной части шейки матки и ее канала. При наличии большой опухоли биопсийный материал берут конхотомом, в остальных случаях — с помощью скальпеля. Обязательным является выполнение раздельного диагностического выскабливания матки.
Состояние регионарного лимфоаппарата оценивают с помощью нижней прямой рентгеноконтрастной лимфографии и магнитно-резонансной томографии. Диагностическая ценность компьютерной томографии и ультразвукового исследования в рассматриваемом аспекте сомнительна, однако они с определенной точностью позволяют установить состояние парааортальных лимфоузлов.
Лечение. Применяются хирургический, комбинированный, сочетанный лучевой, комплексный и лекарственный методы. Наиболее часто используются комбинированное лечение и сочетанная лучевая терапия, эффективность которых при раке шейки матки I и II стадий не отличается; при этом существуют четкие показания к применению каждого из них.
Хирургическое лечение. Показания к этому виду лечения: сочетание рака шейки матки с миомой, воспалительными процессами и опухолями придатков, беременностью; резистентность опухоли к облучению, выявленная в ходе лучевой терапии; «бочкообразная» шейка матки, лейкопения и аномалии развития полового аппарата, препятствующие осуществлению внутриполостной гамма-терапии.
Хирургический метод в самостоятельном варианте традиционно используется при раке шейки матки IА стадии.
Радикальная абдоминальная экстирпация матки. Единого определения понятия «радикальность» гистерэктомии (ГЭ) не существует. Она зависит от анатомической ситуации и распространенности процесса. Условно расширенные экстирпации матки классифицируются на 3-5 типов в зависимости от объема удаляемых тканей (околоматочные и паравагинальные, а также влагалище и тазовые лимфоузлы). Методически типы операций, главным образом, отличаются особенностями работы с мочеточниками, мочевым пузырем и кардинальными связками. Так, при I типе ГЭ (простая ГЭ) мочеточники не выделяются, кардинальные связки пересекаются в непосредственной близости к матке, влагалищная манжета удаляется на протяжении 1-2 см. Это вмешательство применяется при дисплазии III стадии, преинвазивном и микроинвазивном раке шейки матки в случае отсутствия признаков васкулярной инвазии в препаратах, взятых путем конизации.
II тип ГЭ предполагает частичное медиальное выделение мочеточников, удаление медиальной половины кардинальных связок и верхней трети влагалища. Рекомендуется при микроинвазивном раке, характеризующемся признаками инвазии в сосудистые структуры, с последующей ЛАЭ.
При III типе ГЭ (операция Мейгса, Вертгейма-Мейгса, Вертгейма) мочеточники выделяются латерально на всем протяжении от воронкотазовой связки до мочевого пузыря, что позволяет мобилизовать кардинальные связки у стенки таза, удалить большую часть околоматочной клетчатки и верхнюю половину влагалища. Эта операция включает в себя также тазовую ЛАЭ. Она показана при раке шейки матки IB и IIА, IIВ стадий.
III тип ГЭ сопровождается гораздо большей частотой осложнений со стороны мочевыводящих органов, чем обычные вмешательства. При проведении комбинированного лечения (операция и дистанционная лучевая терапия) у больных с раком шейки матки IB и IIА стадий, когда степень вовлечения в патологический процесс тазовых лимфоузлов относительно мала, резекцию латеральной трети кардинальных связок можно не проводить. В случаях использования предоперационной внутри полостной гамма-терапии, обеспечивающей облучение первичного очага и верхней части влагалищной трубки, достаточным считается удаление только верхней трети влагалища.
Техника трансабдоминальной тотальной экстирпации матки с удалением и без удаления придатков.
Расширенная радикальная трансабдоминальная экстирпация матки по Вертгейму включает удаление матки с придатками, параметральной клетчатки и лимфатических узлов по ходу общих и наружных подвздошных сосудов, запирательного нерва, а также удаление верхней половины или трети влагалища. Предпочтительность трансабдоминального доступа обусловлена важностью тщательной ревизии органов брюшной полости.
Лимфаденэктомию осуществляют в определенной последовательности с сохранением целости препарата. Поэтапно удаляют верхние и нижние подвздошные, запирательные и подчревные лимфатические узлы по ходу магистральных сосудов таза. Всю иссеченную клетчатку отсекают от боковой стенки матки. Она содержит от 8 до 23 лимфоузлов с каждой стороны.
После выполнения лимфаденэктомии прослеживают ход мочеточников, мобилизуют маточные сосуды. Мочевой пузырь выделяют до уровня верхней или средней трети влагалища.
Затем рассекают брюшину прямокишечно-маточной складки, прямую кишку, отсепаровывают от шейки матки и влагалища, крестцово-маточные связки клеммируют, рассекают и лигируют на уровне латеральной трети. После отведения мочеточников латерально мобилизуют у стенки таза кардинальные связки. На паракольпии накладывают зажимы, ткани рассекают и лигируют. Препарат удаляют и обеспечивают бестампонное дренирование операционной области через нефиксированные к перитонизационному рубцу боковые стенки влагалища.
Комбинированное лечение включает хирургическое и лучевое, осуществляемые в различной последовательности.
Традиционно комбинированный метод используется при раке шейки матки IB стадии. У больных с раком шейки матки IIA и IIB (редко) стадий он назначается при наличии противопоказаний к сочетанной лучевой терапии.
Наиболее распространенный вариант этого метода включает проведение на первом этапе оперативного пособия.
Послеоперационный курс лучевой терапии назначают для воздействия на оставшиеся в зоне оперативного вмешательства опухолевые клетки или для предупреждения развития местно-регионарных рецидивов в случае выявления таких прогностически неблагоприятных признаков, как наличие опухоли в крае удаленного органа и околоматочных тканей. Проводится дистанционная лучевая терапия на линейных ускорителях или бетатронах суммарной дозой 45-50 Гр, доза за фракцию — 1,8-2 Гр; выполняется 5 сеансов в неделю. При определении опухоли в крае отсечения влагалища назначают дополнительную внутриполостную гамма-терапию вагинальным эндостатом (с применением боковых овоидов или цилиндрической трубки) по 3 Гр 2-3 раза в неделю до суммарной дозы 21-27 Гр (на глубине 0,5 см) на поверхность слизистой верхушки культи влагалища.
Дополнительное лучевое лечение посредством дистанционной лучевой терапии (суммарная доза 40 Гр) показано также пациенткам с полностью удаленными метастатическими узлами, когда в опухолевый процесс вовлекаются лимфососудистые пространства, при недифференцированном или мелкоклеточном раке, а также при размере первичной опухоли более 4 см в диаметре или инвазии опухоли в подлежащие ткани более 1/3 толщи шейки матки.
Опухолевое поражение подвздошных лимфатических узлов является основанием для проведения дополнительного облучения группы парааортальных лимфатических узлов (СОД 40-50 Гр) от верхних границ подвздошного поля (нижний край IV поясничного позвонка) до уровня IX грудного позвонка.
Прочные позиции завоевал вариант комбинированного метода, включающий предоперационную внутриполостную гамма-терапию в режиме крупного фракционирования дозы у больных раком шейки матки IB стадии (Е.Е. Вишневская, 1988). При использовании радионуклидных источников высокой мощности дозы на аппаратах типа «АГАТ» реализуются следующие способы фракционирования: 10 Гр 1 раз в неделю (суммарная доза 20 Гр) или 1 фракция поглощенной дозой 13 Гр (ВДФ составляет 61-74 ед). Облучению подвергается первичный очаг опухоли, что обусловливает абластичность последующей операции и профилактику развития местных рецидивов. Расширенную экстирпацию матки по Вертгейму проводят в день осуществления сеанса гамма-терапии или через 24-48 часов. Применение однократного фракционирования дозой в 13 Гр позволяет преодолеть такие противопоказания для реализации предоперационной внутри-полостной гамма-терапии, как миомы, беременность и воспалительные процессы гениталий.
Через 14 дней после хирургического вмешательства рекомендуется дистанционная лучевая терапия на гамма-терапевтических установках или аппаратах, генерирующих в мегавольтном диапазоне, статическим или ротационным способом с двух или четырех противолежащих полей (надлобково-крестцовых или подвздошно-крестцовых) в режиме фракционирования 2 Гр в сутки, 10 Гр в неделю, до суммарной дозы 30-50 Гр. Дозу на центр таза снижают с помощью блоков.
В ряде случаев, если операция технически невыполнима, больным раком шейки матки IIВ, IIIA, IIIB стадий (размеры опухоли больше 4 см) в силу явных противопоказаний к проведению полного курса сочетанной лучевой терапии на первом этапе лечения проводят дистанционную лучевую терапию на всю анатомическую зону роста опухоли двумя противолежащими полями в режиме обычного фракционирования 5 раз в неделю до суммарной поглощенной дозы 30-50 Гр. Радикальную операцию осуществляют через 2-3 нед.
Сочетанная лучевая терапия (CЛT) используется при всех стадиях рака шейки матки, наиболее часто при раке IIB и особенно III стадий.
Противопоказания: воспалительные процессы в виде осумкованного пиосальпинкса, эндометрита, параметрита; отдаленные метастазы опухоли, прорастание слизистой оболочки смежных с маткой органов и костей таза; острый нефрит, пиелит, хронические заболевания мочевого пузыря и прямой кишки с частыми обострениями; аномалии развития полового аппарата, не позволяющие провести внутриполостную гамма-терапию, опухоли яичников; миомы матки или беременность.
Наиболее приемлемым является способ CЛT по принципу чередования дистанционной и внутриполостной гамма-терапии. На первом этапе проводят дистанционную лучевую терапию с двух статических противолежащих полей размерами (15-16)х( 18-20) см. Нижняя граница полей располагается на середине лонного сочленения или ниже с учетом распространения опухоли на влагалище. Верхняя граница локализуется обычно на уровне нижнего края IV поясничного позвонка. Разовая очаговая доза составляет 2 Гр, недельная — 10, суммарная — 8-14 Гр (I стадия — 8 Гр, II — 10, III — 14 Гр).
Затем присоединяется внутриполостная гамма-терапия на шланговых гамма-терапевтических аппаратах. Предпочтительно фракционирование по 5 Гр 2 раза в неделю до суммарной дозы 40-50 Гр (I стадия — 40 Гр, II — 45, III — 50 Гр). У молодых женщин без сопутствующих заболеваний при низком риске лучевых осложнений, особенно при использовании радионуклидов низкой мощности дозы, возможны следующие варианты укрупненного фракционирования: 7 Гр 1 раз в неделю при числе фракций 7 или 10 Гр 1 раз в неделю при числе фракций 5.
В дни, свободные от сеансов внутриполостной гамма-терапии, продолжают дистанционную лучевую терапию на парамет-ральные отделы тазовой клетчатки по 2 Гр в сутки до суммарной поглощенной дозы 30-50 Гр (I стадия — 30 Гр, II — 40-45, III — 50 Гр). При наличии метастазов в регионарных лимфоузлах дозу на них увеличивают до 55-60 Гр путем применения уменьшенных центрированных полей.
В случаях определения метастазов в парааортальных лимфоузлах или высоком риске их наличия имеет смысл проведение облучения указанной зоны в суммарной дозе 40-50 Гр (по 2 Гр ежедневно, 5 раз в неделю; при осложненной переносимости применяют расщепленный курс).
В США и странах Европы широко используется способ последовательного осуществления дистанционного и внутриполос-тного компонентов CЛT. Схема лечения и суммарные дозы одинаковы при раке шейки матки I, II и III стадий. На I этапе на линейных ускорителях или бетатронах проводят дистанционную лучевую терапию на всю анатомическую зону роста опухоли в суммарной дозе 40 Гр (по 1,8 Гр 5 раз в неделю). Используются два противолежащих поля или «bох»-метод (два противолежащих переднезадних и два латеральных поля). Затем осуществляют два 48-часовых сеанса внутриполостной гамма-терапии радионуклидами низкой мощности дозы с двухнедельным перерывом.
Применяются дополнительные уменьшенные поля на явно метастатические регионарные лимфоузлы, что обеспечивает подведение к ним дополнительной дозы порядка 10 Гр.
Если в силу анатомических или биологических особенностей роста опухоли либо общего ослабленного состояния организма провести непрерывный курс CЛT невозможно (рак шейки матки II-IV стадий), имеет смысл индивидуализировать тактику лучевого лечения на основе расщепленного курса. В общий курс облучения вводится один или более запланированных перерывов длительностью от 2 до 3 нед, а способ подведения дозы к патологическому очагу варьируется в зависимости от специфики типовой клинической ситуации.
Химиотерапия как самостоятельный вариант лечения используется у больных раком шейки матки IV стадии или при рецидивах болезни. При наличии признаков высокой биологической агрессивности опухолевого процесса ее включают в схемы сочетанного лучевого, хирургического и комбинированного лечения.
Предлагаются следующие схемы полихимиотерапии:
1.5-фторурацил — 1 г/м2 внутривенно в течение 3 часов, цисплатин — 75-100 мг/м2 внутривенно в течение 1 часа; повторять каждые 3 нед.
2.Цисплатин — 50 мг/м2 внутривенно в 1-й день, 5-фторурацил — 750 мг/м2 длительно внутривенно в 1-5-й дни; повторять каждые 3-4 нед вместе с лучевой терапией.
3.Цисплатин — 50 мг/м2 внутривенно в 1-й день, ифосфамид (под защитой месны!) — 5000 мг/м2 в виде 24-часовой внутривенной инфузии в 1-й день; повторять через 3 нед до 6 циклов.
4.Еженедельное введение цисплатина (40 мг/м2) в течение 4 ч в ходе лучевой терапии (6 нед).
5.Неоадъювантная внутриартериальная полихимиотерапия (5-фторурацил — 2 г/м2 в течение 48 ч и цисплатин — 100 мг/м2 в течение 24 ч) с последующей лучевой терапией.
6.Введение цисплатина — 10 мг или 5-фторурацила — 250 мг за час до сеанса облучения в ходе лучевой терапии.
Прогноз. К неблагоприятным прогностическим факторам при раке шейки матки относятся: высокая степень распространения опухолевого процесса (размеры опухоли более 4 см, двусторон-ность поражения параметрия при I и II стадиях болезни, наличие метастазов в парааортальных и/или тазовых лимфоузлах); глубокая инвазия в строму у больных с IB стадией; сосудистая инвазия при IB и IIА стадиях; низкодифференцированный и мелкоклеточный рак; возраст до 40-50 лет, маточный вариант распространения патологического процесса, гипоксия опухоли и анемия ниже 80 г/л в периферической крови (при лучевом методе лечения); наличие опухоли в крае иссечения (при хирургическом и комбинированном методах лечения).
Показатели пятилетней выживаемости не зависят от метода лечения и у больных раком шейки матки IА стадии приближаются к 100%, IB стадии — составляют 92-98%, II стадии — 62-84%, III стадии — 30-72%, IV стадии — 0-11%.
Лимфоваскулярная инвазия что это такое в онкологии расшифровка
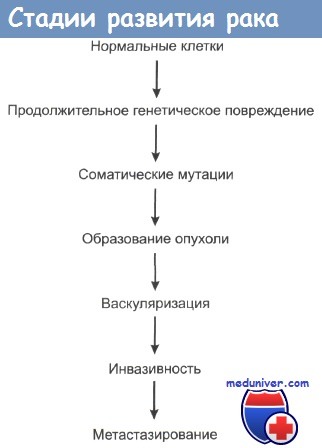
Можно сказать, что раковые клетки в определенной степени не реагируют на механизмы, контролирующие рост и развитие нормальной ткани. При пролиферации нормальной ткани непосредственный контакт клетки со своими соседями обычно служит сигналом к прекращению размножения. Это контактное торможение отсутствует в опухолевых тканях.
При подкожном введении раковых клеток иммунодефицитным мышам происходит рост и развитие опухоли, что никогда не случается при введении здоровых клеток. Раковые клетки отличаются от здоровых по составу мембранных гликопротеинов, по микропотенциалам на клеточной мембране, а также характеризуются повышенным содержанием сиаловой кислоты. Локомоторный клеточный аппарат (микротрубочки и микрофиламенты) раковых клеток деградирует, клетка теряет присущие ей формы, отмечается миграция цитоплазмы раковой клетки в зону контакта со здоровыми клетками.
Одновременно раковые клетки становятся локально инвазивными, хотя биохимические основы этого свойства до сих пор четко не выявлены. Опухолевые клетки часто демонстрируют пониженную адгезивность в сравнении с нормальными клетками. Важным моментом механизма инвазии является секреция определенных ферментов. Некоторые ферменты играют ключевую роль в протеолизе внутриклеточного матрикса, который всегда сопровождает инвазию раковых клеток. К таким ферментам относится семейство матричных металлопротеиназ (ММП), которое включает в себя колллагеназы, желатиназы и стромолизины.
Эти ферменты экскретируются в неактивной форме. Последующий разрыв сульфгидрильной группы и присоединение атома металла (чаще всего цинка) приводят к изменению конформации фермента и переводят его в активное состояние. Тканевые ингибиторы металлопротеиназ (ТИМП) прекращают действие этих ферментов. Некоторые типы тканей изначально обладают повышенной устойчивостью к инвазии. Это, например, компактная костная ткань, ткани крупных сосудов и хрящевая ткань. Предположительно способность к инвазии у опухолевых клеток появляется в результате трансформации нормальных процессов реконструкции и восстановления здоровых тканей. Тем не менее к настоящему моменту неизвестно, какие конкретно изменения генетической структуры раковых клеток ответственны за инвазивный рост.
По мере роста опухоли она выделяет в кровь ангиогенные факторы, которые стимулируют прорастание опухоли кровеносными сосудами и формирование сети капилляров. Сосудистая система кровоснабжения опухоли может стать мишенью для различных видов противораковой терапии. Опухоль стимулирует пролиферацию эндотелиальных клеток, выделяя ангиогенные цитокины, такие как эндотелиальный фактор роста сосудов (ЭФРС), ТФР и факторы роста фибробластов. Эндотелиальные же клетки в свою очередь могут стимулировать рост клеток опухоли. В одном грамме опухолевой ткани может находиться до 10-20 млн эндотелиальных клеток, которые не являются неопластическими.
Антигены нормальных эндотелиальных клеток, включая и профакторы свертываемости крови, могут быть разрегулированы в активно пролиферирующей под действием опухоли эндотелиальной ткани. В дополнение к действию цитокинов, гипоксия, развивающаяся в сети опухолевого кровоснабжения, может стимулировать выбросы ЭФРС и других факторов. В ходе ангиогенеза эндотелиальные клетки внедряются в строму опухоли, активно делятся там с образованием зачатков новых капилляров, которые затем развиваются в сосудистую систему опухоли. Как и в случае инвазии опухолевых клеток, этот процесс идет с участием продуцируемых эндотелием ММП и их естественных ингибиторов.
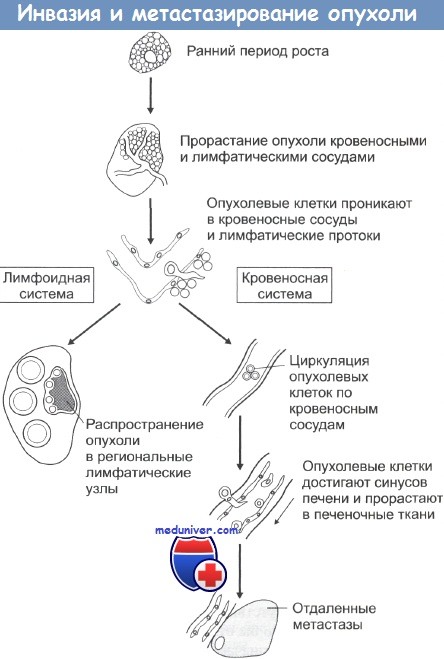
При локальной инвазии рака опухолевые клетки могут попадать в сосудистую систему и давать начало метастазам. Последовательность событий при метастазировании показана на рисунке. Распространение раковых клеток по лимфатической системе, что особенно характерно при карциномах, происходит при попадании опухолевых клеток в лимфатические протоки с последующим оседанием их в местах разветвления протоков и в ближайших лимфатических узлах. Вслед за этим обычно происходит инфильтрация опухолевыми клетками и отдаленных лимфоузлов. Распространение через кровяное русло проходит при проникновении раковых клеток в кровеносные сосуды рядом с местом первичной локализации опухоли либо через грудные протоки. Подхваченные током крови раковые клетки затем захватываются ближайшими капиллярными сетями, чаще всего сетями печени и легких, и оседают в них. При оценке направлений метастазирования очень важно учитывать первичную локализацию опухоли.
Например, опухоли пищеварительного тракта обычно метастазируют через воротную вену в печень. Опухоли также могут метастазировать непосредственно сквозь прилегающие ткани. Так возникающие в брюшной полости новообразования могут очень быстро рассеяться по всему внутрибрюшинному пространству, а клетки рака легкого могут мигрировать через плевру. Некоторые опухоли метастазируют в определенные органы и ткани, другие — бессистемно. Саркомы, например, почти всегда метастазируют в легкие, рак молочной железы поражает также ткани осевого скелета. Тем не менее биологических механизмов, объясняющих такую избирательность, пока не найдено.
Региональные лимфоузлы могут осуществлять барьерную функцию, предотвращая распространение метастазов за пределы области первичной локализации опухоли. До сих пор четко не выяснено, каким образом и за счет каких специфических иммунных механизмов лимфатические узлы создают барьер на пути распространения опухоли.
Проникая в кровеносное русло в районе первичной опухоли, раковые клетки затем могут достигать других органов и тканей. Для того чтобы дать начало новым очагам опухоли, эти клетки на новом месте должны, во-первых, проникнуть в ткани через эндотелий капилляров, а во-вторых, выжить при атаках местных иммунных систем защиты, таких как фагоцитирующие клетки и так называемые естественные киллеры (ЕК).
Способность к инвазированию и расселению в отдаленных органах и тканях у различных видов опухолей сильно варьирует. Эта способность, по-видимому, определяется степенью экспрессии того участка генома, который и обусловливает злокачественный рост клеток. Действительно, со временем почти все раковые опухоли накапливают все больше и больше генетических изменений в своих клетках и приобретают способности к инвазии и метастазированию. Но даже при клиническом обнаружении опухоли метастазы и инвазия могут проявиться лишь спустя несколько лет. Типичным примером является карцинома низкой степени злокачественности. Следует отметить, что даже однотипные виды рака с одинаковой степенью дифференцированности опухолевых клеток по-разному метастазируют у разных больных.
Все это говорит о необходимости поиска молекулярных маркеров, которые смогли бы предсказывать исход течения онкологического заболевания более точно, чем диагностика по гистологическому типу опухоли (хотя последний метод в настоящее время является наиболее точным из всех возможных). Кроме того, даже конкретная опухоль может быть в значительной степени гетерогенной и состоять из клеток, различных по своему метастатическому потенциалу, что было показано на клонированных субпопуляциях, выделенных из одной опухоли. Биологические причины такой вариабельности в настоящее время неизвестны.
Совершенно ясно, что для успешного лечения онкологических пациентов необходимо проводить масштабные исследования в области нахождения механизмов тканевой инвазии, метастатического роста и поиска биологических причин гетерогенности опухолей. Отсутствие гомогенности в опухолях, сходство опухолевых клеток со здоровыми клетками породившей ее ткани, и отсутствие четкого единичного критерия, по которому можно было бы отличить раковую клетку от здоровой, — все это вместе означает, что наши рассуждения о противоопухолевом иммунитете или о механизмах действия лекарственных цитостатических препаратов должны приниматься с изрядной долей скептицизма, особенно если они базируются на экспериментах с гомогенными опухолевыми культурами.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021