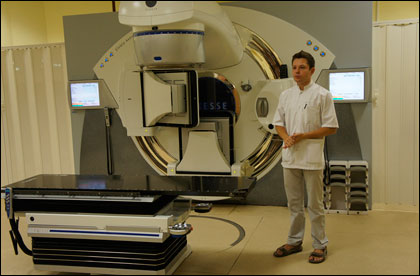
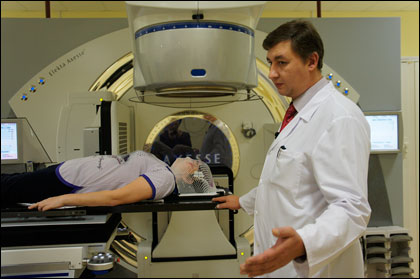
Линейный ускоритель это что
Линейный ускоритель – это радиотерапевтический комплекс, который используется для проведения облучения злокачественных новообразований. Системы визуализации и синхронизации с дыханием пациента дают возможность точного дозирования радиации в центре злокачественной опухоли. Инновационные технологии позволяют минимизировать повреждение здоровых тканей, сократить длительность лечения и значительно уменьшить время воздействия облучения.
Линейные ускорители: ощутите разницу
Чем отличается лечение на линейном ускорителе от обычной лучевой терапии? При проведении лучевого облучения на традиционных аппаратах, используется мощное гамма-излучение, которое эффективно разрушает опухоль. Существенным недостатком устаревшей технологии является неуправляемое излучение, которое поражает здоровые ткани и органы, что ведет к инвалидизации и снижению качества жизни онкобольных.
Современные линейные ускорители отличает отсутствие в них радиоактивных элементов. Облучение осуществляется узконаправленными лучами, в месте пересечения которых образуется высокая концентрация радиации на область новообразования. Также различаются способы определения формы и расположения опухоли. Инновационные технологии позволяют формировать участок облучения по форме пораженных тканей, что дает возможность использовать линейные ускорители для лечения онкологии подвижных новообразований при естественном изменении их положения.
Что лечат?
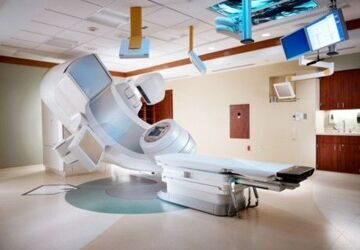
Краткий обзор линейных медицинских ускорителей
Линейный ускоритель в медицине – настоящая панацея и дает надежду на выздоровление и улучшение качества жизни более чем 80% больным онкологией. Медико-биологические комплексы радиационной терапии отличаются надежностью и многоуровневыми системами автоматизации:
Стоимость лучевой терапии
Линейный ускоритель – цена сопоставима с лечением по устаревшим технологиям. Например, стоимость курса лучевой терапии (10 – 15 процедур) на линейном ускорителе Вариан (Varian) начинается от 100 000 рублей. Цена варьируется в зависимости от объемов подготовительного этапа, стадии заболевания, локализации и формы опухоли.
Радиология и радиохирургия
Медицинский линейный ускоритель
Что такое медицинский линейный ускоритель?
Линейный ускоритель применяется при стандартной лучевой терапии, радиотерапии с модулированной интенсивностью, радиотерапии под визуальным контролем, стереотаксических радиохирургических вмешательствах и экстракраниальной стереотаксической радиотерапии.
Каков принцип работы линейного ускорителя?
В основе работы линейного ускорителя лежат микроволновые технологии, подобные принципам действия радара. В волноводной системе линейного ускорителя происходит разгон (ускорение) электронов, которые затем сталкиваются с препятствием из тяжелого металла, что сопровождается выработкой высокоэнергетического рентгеновского излучения. На выходе из линейного ускорителя форма полученного пучка лучей подстраивается под параметры опухолевого очага, что обеспечивает его точное облучение.
Изменение формы пучка происходит с помощью многолепесткового коллиматора, встроенного в ускоритель, или специальных блоков, которые укрепляются на аппарате извне.
Во время лечения пациент располагается на подвижной кушетке, а положение его тела оценивается с помощью лазерной системы. Кушетка может перемещаться в разных направлениях: вверх, вниз, вправо, влево, вперед и назад.
Пучки лучей выходят из устройства под названием гентри, которое вращается вокруг кушетки.
Перемещения стола пациента и вращение гентри вокруг него обеспечивают возможность доставки излучения к опухоли под самыми разными углами.
Кто управляет линейным ускорителем?
Объем необходимого радиотерапевтического вмешательства и дозу излучения определяет лечащий онколог-радиолог. Способ доставки назначенной дозы, а также расчет времени, которое для этого требуется линейному ускорителю, выбирает медицинский физик и дозиметрист. Непосредственный сеанс радиотерапии проводит врач-радиолог, который и управляет линейным ускорителем.
Каким образом обеспечивается безопасность при работе линейного ускорителя?
Безопасность пациента является одним из важнейших приоритетов при проведении радиотерапии. Она обеспечивается за счет следующих моментов.
Перед началом лечения осуществляется разработка плана лучевой терапии, который должен получить одобрение со стороны онколога-радиолога, медицинского физика и дозиметриста. Разработанный план проходит двойной контроль качества, что позволяет убедиться в его соответствии заявленным требованиям по лечению. Кроме этого, крайне важен контроль работы линейного ускорителя. Для этого в аппаратуру встраивается несколько контролирующих систем, что не позволяет превысить дозу, назначенную онкологом-радиологом.
Перед началом каждого сеанса радиолог или техник-радиолог с помощью специального устройства проверяет точность работы линейного ускорителя и оценивает равномерность излучения по ходу всего пучка. Более подробная проверка оборудования проводится еженедельно и ежемесячно.
Современные линейные ускорители снабжены встроенными системами контроля, которые обеспечивают дополнительную безопасность. При этом оборудование нельзя включить до того момента, пока не будут достигнуты все требования к параметрам лечения, назначенным врачом.
В течение всего сеанса врач непрерывно наблюдает за пациентом с помощью телевизионной системы. Кроме этого, процедурный кабинет оснащен микрофоном, с помощью которого пациент при необходимости может общаться с медицинским персоналом.
Во время сеанса проводится регулярная рентгеновская съемка, что позволяет убедиться в отсутствии отклонений параметров пучка лучей от ранее заданных. Кроме безопасности пациента, работа линейного ускорителя не должна приносить вред и медицинскому персоналу. Оборудование для проведения радиотерапии обычно располагается в кабинетах, экранированных свинцовыми и бетонными стенами, которые непроницаемы для рентгеновских лучей. При этом включение линейного ускорителя врачом производится извне процедурного кабинета.
Поскольку ускоритель генерирует излучение только во включенном состоянии, риск непреднамеренного облучения крайне невелик. Прекрасная защита операторского пульта позволяет работать с линейным ускорителем даже беременным женщинам.
(495) 506-61-01 — справочная по радиотерапии и радиохирургии
Что такое и как работает линейный ускоритель
В этом аппарате электроны, т.е. отрицательно заряженные частицы, ускоряются с помощью высокочастотного излучения и могут непосредственно использоваться для облучения опухолей. Поскольку электроны не способны глубоко проникать в ткани, их применяют, например, для лечения кожных опухолевых заболеваний. Для облучения злокачественных новообразований, расположенных в более глубоких слоях тканей, необходимо использовать фотонное излучение. Когда ускоренные электроны сталкиваются с препятствием (мишенью), изготовленным из тяжелого металла, чаще всего вольфрама, это сопровождается выработкой высокоэнергетического рентгеновского излучения. Чем мощнее фотонное излучение, тем больше глубина его проникновения в ткани. После столкновения с мишенью луч проходит первичный коллиматор, который определяет максимальную площадь зоны облучения, и фильтр, обеспечивающий однородность излучения. Затем форма полученного пучка лучей подстраивается под параметры опухолевого очага, что обеспечивает его точное облучение. Это достигается с помощью многоступенчатого коллиматора (мультиколлиматора). В головке прибора для облучения находятся до 160 пластин шириной от 1до 16мм, которые при планировании процедуры облучения принимают контуры опухоли. Данные позиций каждой из пластин сохраняются и во время сеанса облучения передаются на линейный ускоритель, где подстраиваются с точностью до миллиметра под анатомические параметры пациента.
Как работает компьютерный томограф (КТ) и осуществляется симуляция (моделирование) процесса лучевой терапии.
С помощью снимков, полученных при помощи компьютерного томографа, начинается планирование процесса облучения. Процедурный стол, положение тела пациента и вспомогательные средства фиксации позиций тела идентичны данным линейного ускорителя. После центрации тела пациента на лечебном столе компьютерный томограф производит серию снимков области опухоли, на которых врач очерчивает контуры зоны предстоящего облучения.
Рентгеновский симулятор представляет собой рентгеновский диагностический аппарат, который в точности повторяет все параметры и конструктивные особенности линейного ускорителя. В нем также совпадают данные о позиции тела пациента на процедурном столе с данными линейного ускорителя. Все необходимые замеры, рассчитанные при планировании процесса облучения, переносятся с помощью симулятора на пациента перед первым сеансом терапии. В первую очередь – это точная позиция (положение) тела пациента, угол падения луча, границы облучаемой мишени. Все эти данные сохраняются в цифровом рентгеновском снимке.
Пошаговый процесс лучевой терапии на линейном ускорителе:
1. Утверждение концепции лечения. Для каждого пациента в отдельности бригадой врачей разных медицинских направлений – хирургов, терапевтов, патологов, радиологов, специалистов в области ядерной медицины, психоонкологов, представителей паллиативной медицины – в ходе так называемой онкологической конференции разрабатывается индивидуальный курс лечения.
2. Информирование пациента. В подробной беседе онколог-радиолог разъясняет пациенту, необходимо ли применение лучевой терапии в качестве единственного способа лечения в его случае, или возможны комбинации с радиосенсибилизирующими (радио-химиотерапия, иммунотерапия) и/или радиоактивными веществами для внутреннего облучения.
3. Подготовка пациента к процессу облучения. Пациента укладывают на процедурный стол и надежно закрепляют на нём положение тела больного с помощью различных специальных устройств (фиксаторов, масок), изготавливаемых в инженерной лаборатории медицинской физики. В ходе сеанса лучевой терапии это положение нельзя менять для того, чтобы обеспечить точность облучения.
4. Получение компьютерных изображений для проведения процедуры лучевой терапии. При составлении плана лечения используются различные методы визуализации, например, компьютерная томография (КТ), позитронно-эмиссионная томография (ПЭТ), магнитно-резонансная томография (МРТ). Эти приборы делают снимки области опухоли, в которую будет направлено излучение. С их помощью онколог- радиолог сможет четко дифференцировать границы облучаемой опухоли от здоровых тканей в процессе подготовки к лечению.
5. Планирование лучевой терапии. Планирование лучевой терапии осуществляют совместно онколог-радиолог и медицинский физик. Онколог определяет целевую область облучения и отмечает её вместе с медицинским физиком на компьютерных снимках. Кроме того, он указывает, куда и какая доза облучения должна подаваться, а медицинский физик рассчитывает распределение доз. Наконец, они вместе оценивают план. Если план одобрен обоими, то можно начинать лечение.
6. Имитация процесса лечения на тренажере. Прежде, чем начать процедуру облучения, пациента укладывают на стол тренажёра (симулятора). Ему наносят метки так, чтобы положение тела во время симуляции (а значит, и во время последующего лечения) были абсолютно идентичными. Затем проводят имитацию процесса облучения в соответствии с предварительно составленным планом. Таким образом, процесс симуляции позволяет сопоставить план облучения с реальным процессом лечения на терапевтическом аппарате. На данном этапе есть возможность его корректировки в соответствии с реальной картиной, а затем приступить непосредственно к лечению.
7. Сеанс лучевой терапии. Во время проведения процедуры о пациенте заботятся медицинские технические ассистенты-радиологи. Их задача состоит в подготовке пациента к сеансу терапии и обслуживании медицинского линейного ускорителя. При этом они тесно взаимодействуют с врачами, медицинскими физиками, работниками медико-физической инженерной лаборатории. Сама же процедура терапии проводится очень быстро: согласно разработанному плану, она длится от нескольких секунд до нескольких минут.
8. Контроль во время сеанса облучения. Во время процесса лучевой терапии следует постоянный контроль точности облучения с помощью серии снимков из компьютерного томографа или рентгеновского аппарата. Проверяется расположение опухоли, которая может находиться в движении, например, при дыхании или сердцебиении, и, в соответствии с этим, производится корректирование положения пациента на процедурном столе.
9. Беседы с врачом во время лечебной процедуры. Во время лечебного сеанса поддерживается постоянная связь пациента с лечащим врачом. При возникновении каких-либо вопросов или проблем пациент в любой момент может обратиться к онкологу-радиологу.
10. Окончание сеанса лучевой терапии. После завершения процедуры следует подробный окончательный разговор пациента с врачом о том, завершен ли курс лечения или ещё необходимо применение других терапевтических мер, например, радиохимиотерапии.
11. Послеоперационное обслуживание пациента. Спустя 4-6 недель после окончания радиотерапии пациент посещает клинику. Врач тщательно обследует его, выясняет эффективность использованного метода лечения: находится ли развитие опухоли под контролем или пациент полностью излечился от онкозаболевания. Кроме того, проверяется наличие побочных эффектов или последствий, чтобы назначить соответствующее лечение. Согласно нормативным документам, последующее наблюдение за пациентом продолжается в течение нескольких лет и осуществляется в тесном сотрудничестве с его профильным врачом и семейным доктором.
СОДЕРЖАНИЕ
Строительство и эксплуатация
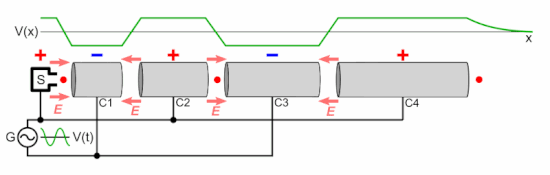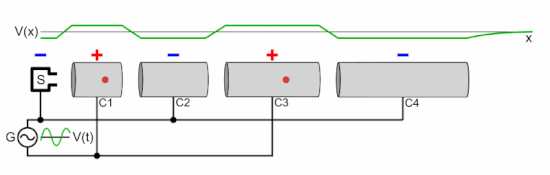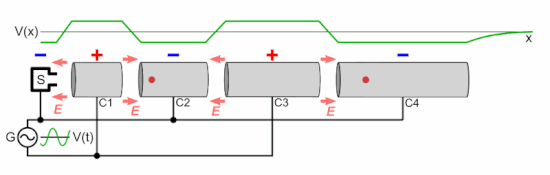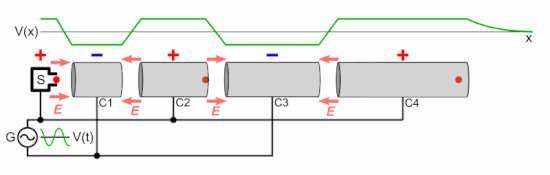
Линейный ускоритель частиц состоит из следующих частей:
Как показано на анимации, колебательное напряжение, приложенное к чередующимся цилиндрическим электродам, имеет противоположную полярность ( сдвиг по фазе на 180 ° ), поэтому соседние электроды имеют противоположные напряжения. Это создает колеблющееся электрическое поле (E) в зазоре между каждой парой электродов, которое оказывает силу на частицы, когда они проходят, передавая им энергию, ускоряя их. Источник частиц вводит группу частиц в первый электрод один раз за каждый цикл напряжения, когда заряд на электроде противоположен заряду на частицах. Электроды имеют правильную длину, так что ускоряющие частицы проходят через каждый электрод ровно за половину цикла. Каждый раз, когда сгусток частиц проходит через электрод, колебательное напряжение меняет полярность, поэтому, когда частицы достигают зазора между электродами, электрическое поле имеет правильное направление для их ускорения. Следовательно, частицы ускоряются до более высокой скорости каждый раз, когда проходят между электродами; внутри электродов небольшое электрическое поле, поэтому частицы перемещаются с постоянной скоростью внутри каждого электрода.
E знак равно q N V п <\ displaystyle E = qNV_
>
На скоростях, близких к скорости света, приращение скорости будет небольшим, а энергия будет проявляться как увеличение массы частиц. В тех частях ускорителя, где это происходит, длина трубчатых электродов будет почти постоянной. Могут быть включены дополнительные магнитные или электростатические линзовые элементы, чтобы гарантировать, что луч остается в центре трубы и ее электродов. Очень длинные ускорители могут поддерживать точное выравнивание своих компонентов за счет использования сервосистем, управляемых лазерным лучом.
Концепции в разработке
Индукционный линейный ускоритель
Восстановление энергии LINAC
Компактный линейный коллайдер
Ускоритель Кильфельда (плазменный ускоритель)
Компактные медицинские ускорители
Программа LIGHT (линейный ускоритель для адронной терапии с визуальным контролем) надеется создать конструкцию, способную ускорять протоны до 200 МэВ или около того для медицинского использования на расстоянии нескольких десятков метров, путем оптимизации и вложения существующих методов ускорителя Текущий проект (2020 г. ) использует наивысшую практическую частоту группы (в настоящее время
3 ГГц) для каскада радиочастотного квадруполя (RFQ) от инжекции при 50 кВ постоянного тока до групп
5 МэВ, линейный ускоритель с боковой дрейфовой трубкой (SCDTL) для ускорения от 5 МэВ до
Современные концепции линейных ускорителей
Чем выше частота выбранного ускоряющего напряжения, тем больше отдельных ускоряющих толчков на длину пути испытывает частица с заданной скоростью, и, следовательно, тем короче может быть ускоритель в целом. Вот почему технология ускорителей развивалась в поисках более высоких энергий частиц, особенно в сторону более высоких частот.
Концепции линейных ускорителей (часто называемые структурами ускорителей в технических терминах), которые используются примерно с 1950 года, работают с частотами в диапазоне от примерно 100 мегагерц (МГц) до нескольких гигагерц (ГГц) и используют компонент электрического поля электромагнитных волн.
Стоячие волны и бегущие волны
Гамма-нож и линейный ускоритель: что способно победить рак?
Дальнейшие события в отечественной онкологии можно назвать драмой (хотя слово трагедия подходит лучше): в 90-е годы отечественная промышленность разваливается, и закупки зарубежной техники становятся мизерными, такая ситуация продолжалась более 10 лет…
Статистика говорит сама за себя
В 2009 г., когда стартовала НОП «Мероприятия по совершенствованию медицинской помощи онкологическим больным» (до 2015 года), смертность от онкологических заболеваний в РФ занимала второе месте, а на учете в онкологических учреждениях состояло 1,8% населения; прирост же заболеваемости раком за истекшее десятилетие – превысил 14%.
Андрей Черниченко: Онкозаболеваемость в России постепенно растет, начиная с 60-х годов
Российские цифры выглядят особенно удручающе на фоне статистики в развитых странах: например, с 2001 по 2005 заболеваемость раком у мужчин в США ежегодно снижалась на 1,8% (по данным American Cancer Society).
Заметим, что 2/3 онкологических больных в США проходят сеансы радиотерапии.
Сфокусированное определенным образом невидимое излучение во время сеанса лучевой терапии или радиохирургии проникает вглубь тела пациента. В качестве некой аналогии можно привести оптические приборы, которые фокусируют дневной свет, однако в случае с радиоволнами точка фокуса находится не на поверхности, а в глубине тела пациента – на опухоли.
В процедуру с применением ускорителя или гамма-ножа входит снятие реперных точек на томографе, проверка на фантоме перед началом сеанса, а так же использование в ряде случаев специальной стереотаксической системы для повышения точности координат мишени и мн.др. Ко всему же процессу, в принципе, вполне применимы понятия workflow или «технологическая цепочка».
Руслан Шафиулин: Врачи и медицинские физики работают с линейным ускорителем только совместно
Линейный ускоритель отличается от описанного ранее гамма-ножа типом используемого излучения: он разгоняет и направляет поток электронов, сталкивающихся на конце своего пути с промежуточной (технологической) мишенью, в результате чего генерируется рентгеновское излучение. Помимо точной фокусировки в точке опухоли, прецизионного механического вращения рентгеновского излучателя и др. мер, для защиты здоровых тканей применяют регулируемый мультилепестковый коллиматор (лепестки задерживают часть излучения), системы контроля за качеством и количеством излучения во время сеанса и др. Другое характерное отличие от гамма-ножа – более широкая сфера применения ускорителя, то есть его универсальность. Например, Elekta Axesse позволяет проводить как сеансы, лучевой терапии так и радиохирургии, причем различных органов и систем.
Чтобы не вдаваться в технические подробности, разницу между современным прецизионным медицинским ускорителем (со всей необходимой инфраструктурой) и примитивным рентгеновским устройством из прошлого века можно описать как разницу между телегой с лошадью и космической ракетой (хотя, в принципе, и то и другое можно формально отнести к «средствам передвижения»). Она заключается не в конкретных параметрах и общих принципах работы, а в технической реализации устройства, степени соответствия требованиям медиков, технологичности и точности. «Существует мнение, что разница между хорошей и плохой лучевой терапией составляет 2 мм», – считает Дмитрий Балалыкин.
В России должно быть больше техники
Поставляемые в РФ Gamma Knife и Elekta Axesse – это примеры современной онкологической техники среди длинного перечня устройств с разными принципами действия и назначением, разработанных различными производителями (Siemens, Varian, Elekta и др.) и используемых, преимущественно, в развитых странах. Помимо прочего, есть также и некий опыт применения для лечения опухолей ускорителей, используемых в физических экспериментах и др. К 2015 году для реализации НОП современной техникой планируется оснастить все государственные онкологические учреждения. Приказ № 944н Министерства здравоохранения и социального развития РФ от 3 декабря 2009 г. позволяет рассчитать нормативы: в частности, из расчета на 300 тыс. населения должен приходится один аппарат для дистанционной лучевой терапии: линейный ускоритель или кобальтовый источник ионизирующего излучения и т.д. Необходимо заметить, что эти нормативы во много раз меньше, чем в некоторых западных странах, таких, например, как Нидерланды. Тем не менее, «закупка современной техники позволит быстро изменить ситуацию с точки зрения пациентов, решить вопрос доступности современной медицинской помощи», – справедливо полагает Дмитрий Балалыкин.
Дмитрий Балалыкин: Из опыта западных стран можно уже сегодня позаимствовать практику создания частных центров лучевой терапии
5 сеансов из 10-ти возможных
В России есть 6 аппаратов Elekta Axesse, во всем мире их около 30
Одно из применений Elekta Axesse – радиохирургическое. «Она показана 10% больных, нуждающихся в онкологической помощи. Чтобы подвести однократно высокую дозу и моментально излечить больного, мишень должна быть в районе 2-3 см. В ряде случаев помочь больному с помощью Elekta Axesse бывает невозможно», – описал плюсы и минусы Elekta Axesse Андрей Черниченко. Согласно статистике, до начала НОП больше половины больных поступали в учреждения с диагнозом: рак 3-й или 4-ой стадии. Это означает, что шансы на излечение у таких больных не выше 30%. Улучшение оснащенности аппаратурой онкологических учреждений в РФ позволит сократить время до лечения, а ранняя диагностика позволит эффективно задействовать и полностью загрузить выскотехнологичное оборудование.
«Прежде чем территория вступит в программу НОП, она должна наладить диспансеризацию и маршрутизацию пациента, которая начинается с уровня районных больниц, фельдшерско-акушерских пунктов, участковых терапевтов, стоматологов и т.д. Это организационная часть НОП, и она, в ряде случаев, не требует капитальных вложений. Кроме того, поставлена задача повысить степень онкологической настороженности всех медицинских работников для диагностики опухолевых заболеваний на ранних стадиях, когда до 90-95% больных еще могут быть излечены», – сообщил Андрей Черниченко.
Специалисты нового поколения
«В нашей компании сегодня работает 20 медицинских физиков, а это больше, чем во всех федеральных НИИ вместе взятых. Мы участвуем в подготовке таких специалистов совместно с профильной кафедрой физфака МГУ им.М.В.Ломоносова, 4 выпускника этой кафедры работают сегодня в МНИОИ им. П.А.Герцена» – сообщил Дмитрий Балалыкин.
РАТОР выделяет гранты для поддержки исследований и написания кандидатских диссертаций. В апреле этого года (примерно через 100 лет после открытия лучей рентгена) в России выделена новая специальность) – радиотерапия. «31 мая у нас была создана первая в России кафедра онкологии и радиотерапии. Готовится открытие соответствующих направлений в регионах, имеющих соответствующую техническую и научно-практическую базу для обучения; помимо федеральных центров, в рамках НОП оснащены окружные онкодиспансеры в Челябинске, Хабаровске и других городах», – сообщил Андрей Черниченко.
Решением накопившихся в отечественной онкологии проблем (является) не только закупка оборудования, но и организация его полноценной сервисной поддержки на территории РФ (а для этого нужны специализированные инженерные компании), установка, настройка и тестирование перед каждым сеансом, соблюдение регламентов технической поддержки и многое другое. Только наличие квалифицированных кадров позволит оказать высокотехнологичную медицинскую помощь в массовом порядке, повысить пропускную способность имеющегося оборудования и важно для производства современной медицинской техники на территории РФ. «Уровень жизни (крайне дефицитного) российского медицинского физика сопоставим с тем уровнем, который он получит, если уедет работать, допустим, в США или Германию. Если разницы нет, то зачем туда ехать?» – спрашивает Дмитрий Балалыкин.
Дмитрий Балалыкин: «Уровень жизни российского медицинского физика сопоставим с тем, который он получит в США или Германии
Подготовка кадров, налаживание массового своевременного онкологического скрининга, возрождение отечественной медицинской промышленности, закупка оборудования для диагностики и лечения (а также всей требующейся для его работы инфраструктуры) в необходимых для оснащения всех регионов к 2015 г. количествах, выделение в этих целях помещений и создание новых центров, выполнение других условий НОП, а также удаление коррупционной «опухоли» из экономики позволит сократить отставание России от западных стран в ближайшие годы, сделать первый шаг на пути, по которому уже давно идут многие страны.
Конкретные же результаты НОП можно будет попытаться оценить, например, посмотрев через несколько лет на аналогичный с приведенным ранее график с российской статистикой онкологических заболеваний.