Миоклонические судороги что это у детей
Миоклонические судороги что это у детей
При некоторых эпилепсиях старшего детского и подросткового возраста миоклонии составляют преобладающий, если не исключительный тип припадков. Эпилепсии, характеризующиеся выраженными миоклоническими феноменами, в этом возрастном промежутке в большинстве случаев идиопатические по происхождению. Очень часто наблюдается выраженная генетическая предрасположенность к судорожным расстройствам (Arzimanoglou et al., 2004).
Более типичный в старшем детском и подростковом возрасте феномен — последовательность миоклонических судорог, часто перерастающая в генерализованный тонико-клонический припадок (клонически-тонико-клонический припадок). Течение и лечение миоклонических атак, описываемых в этом разделе, отличаются от течения и лечения синдромов Леннокса-Гасто и Драве, описанных в предыдущих разделах. Важно правильно распознать тип припадка, для этого требуется не только подробный опрос родителей, но также при наличии показаний выполнить полиграфию и/или видео-ЭЭГ.
Также важно точно определить другие типы припадков, обычно сопровождающих миоклонические атаки, так как именно сопутствующие припадки являются ключевым признаком классификации миоклонических эпилепсий.
Эпилептические синдромы с выраженным миоклонусом можно разделить на три основные категории:
1. те, при которых миоклонусу сопутствуют в основном абсансы (эпилепсия с миоклоническими абсансами и миоклония век с абсансами);
2. те, при которых миоклонические атаки избирательно индуцируются прерывистой фотостимуляцией;
3. эпилепсии, начинающиеся в подростковом возрасте, при которых основным типом припадков является grand mal, но могут также наблюдаться и абсансные атаки (т.е. ювенильная миоклоническая эпилепсия, обсуждаемая ниже);
4. эпилепсии, дебютирующие в широком возрастном диапазоне, от старшего детского до взрослого возраста, с наибольшей выраженностью наследственного фактора, с выраженным ритмичным дистальным миоклонусом и генерализованными судорогами, и тонико-клоническими и фокальными припадками у некоторых пациентов. Duron et al. (2005) проанализировали частоту различных типов припадков при генерализованном эпилептическом синдроме, их зависимость от возраста, и временной профиль припадков.
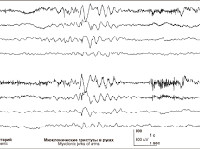
Слева видны быстрые (4 Гц) разряды спайк-волн с полиспайками в начале (без клинической корреляции).
Справа показаны миоклоническая судорога (виден миографический артефакт на ЭКГ) и разряды полиспай-ков на ЭЭГ.
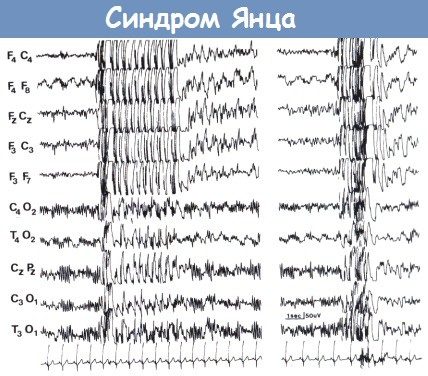
а) Ювенильная миоклоническая эпилепсия (ЮМЭ). ЮМЭ (также называемая миоклонической эпилепсией подросткового возраста или синдромом Янца) — наиболее частый и узнаваемый синдром идиопатической генерализованной эпилепсии. Заболевание начинается между 12 и 18 годами жизни (Delgado-Escueta и Enrile-Bacsal, 1984; Janz, 1989), но может дебютировать и вне этогих возрастных рамок. Иногда это состояние называют «миоклонический petit mal» или «импульсивный petit mal», что вносит путаницу, так как оно совершенно отлично от абсанс эпилепсии. ЮМЭ встречается у 5-11% подростков с эпилепсией. Миоклонические судороги поражают в основном плечи и руки, редко — нижние конечности.
Они могут быть асимметричными и даже односторонними (Genton et al., 1994; Janz, 1994). Сознание обычно сохранено, но из-за непроизвольных движений пациент часто роняет предметы, которые держит в руках во время припадка.
Судороги возникают в основном после пробуждения и могут быть единичными сокращениями или серийными судорогами, однако редко достигающими состояния миоклонического статуса. У 90% пациентов наблюдаются сопутствующие генерализованные тонико-клонические припадки. Иногда они могут развиваться вслед за сериями судорог, такую последовательность называют клонико-тонико-клоническим припадком. От 15 до 30% пациентов также имеют абсансы. Сложные взаимосвязи между различными идиопатическими эпилепсиями обсуждались Thomas et al. (2005).
Типичная иктальная ЭЭГ состоит из вспышек спайков высокой частоты, за которым следует одна или несколько медленных волн. Такие же комплексы полиспайк-волна могут наблюдаться в интериктальный период. Фокальные ЭЭГ-проявления могут присутствовать почти в 20% случаев (Panayiotopoulos, 1994а). Лишение сна и, часто, фотостимуляция, могут провоцировать припадки.
Около 80% пациентов хорошо реагирует на терапию вальпроатом натрия, но курс лечения необходимо продолжать, возможно, неопределенно долго. У женщин с ЮМЭ при выборе наиболее подходящего АЭП нужно учитывать возможность предстоящей беременности (Tomson и Battino, 2005). В резистентных случаях нужно попытаться назначить бензодиазепины. Также применялся ламотриджин, с вариабельным эффектом, включая ухудшение или отсутствие контроля миоклонических судорог в некоторых случаях. Топирамат и зонисамид являются интересными альтернативными препаратами. Рандомизированное двойное слепое контролируемое исследование выявило явную эффективность леветирацетама для контроля миоклонических судорог при ЮМЭ (Verdu et al., 2005).
Специфический профиль фармакочувствительности при ЮМЭ, совпадающий с профилем других идиопатических генерализованных эпилепсий, указывали Thomas et al. (2006); они подчеркивали потенциальную возможность усиления припадков при использовании фенитоина и особенно карбамазепина, который даже может спровоцировать миоклонический статус. Очень важным фактором в предотвращении припадков, вызываемых лишением сна, является устранение причин, препятствующих физиологическому сну.
Реакция на лечение отличная или хорошая, полный контроль припадков достигается в 80-90% случаев; спонтанная ремиссия, как сообщается, наступает очень редко. С другой стороны, рецидив припадков после прекращения лечения случается часто, даже после контроля припадков в течение многих лет, но в некоторых случаях может задержаться на несколько лет (Thomas et al., 2005).
Диагноз обычно не вызывает трудностей. Однако необходимо исключать редкие прогрессирующие миоклонические эпилепсии, такие как болезнь Лафора и некоторые случаи болезни Унферрихта-Лундборга, так как в начале заболевания они могут имитировать ЮМЭ. Последовательное ухудшение миоклонического синдрома, появление медленной фоновой ЭЭГ-активности и деградация когнитивных функций предполагает вероятность наличия прогрессирующего заболевания (Arzimanoglou et al., 2004).
Генетические факторы играют значительную роль в этиологии этого синдрома. Было выполнено несколько исследований (подробнее см. Thomas et al., 2005), предполагается связь с коротким плечом 6 хромосомы или длинным плечом 15 хромосомы. Результаты семейных исследований, в основном касающиеся механизма наследования, часто противоречивы. Существующая полигенная модель считается наиболее вероятной (Bate и Gardinger, 1999), и может объяснить неоднозначные и противоречивые результаты исследований связи с хромосомами, основанных на упрощенных менделевских моделях наследования.
Такая полигенная модель предполагает наличие общей центральной группы генов, вызывающих снижение эпилептогенного порога при идиопатических генерализованных эпилепсиях, в этом случае специфические проявления ЮМЭ явились бы следствием действия одного или нескольких других генов (Sander et al., 2000).
б) Миоклония век с абсансами. Это расстройство характеризуется очень частым возникновением судорог век с отведением глазных яблок вверх, которым может сопутствовать короткий период легкого отсутствия восприятия (Jeavons, 1982; Appleton et al., 1993; Panayiotopoulos, 1998). На ЭЭГ выявляются разряды коротких (менее 6 секунд) комплексов полиспайк-волна, отмечается выраженная фоточувствительность. Эффективно лечение вальпроатом натрия и другими АЭП, показанными при идиопатических эпилепсиях, но, возможно, лечение должно продолжаться и во взрослом возрасте.
в) Другие миоклонические синдромы. Они включают поздние случаи, идентичные «доброкачественной миоклонической» эпилепсии, с поздним началом в возрасте до 5-6 лет (Guerrini et al., 1994а) и самопроизвольные фотомиоклонические припадки.
Наследуемые по аутосомно-доминантному механизму кортикальный тремор, миоклонус и эпилептические припадки, наблюдавшиеся во многих японских и европейских семьях, описывались под разными названиями, сейчас они известны как семейная миоклони-ческая эпилепсия взрослых. Striano et al. (2005) изучили семейные случаи с такой клинической картиной и заключили, что, несмотря на их генетическую гетерогенность, все они представляют одно клиническое состояние, в японских семьях сцепленное с 8q24, а в итальянских — с 2р11.1-q12. Может быть задействован и третий локус, были зафиксированы спорадические случаи с такими же характеристиками.
Редактор: Искандер Милевски. Дата публикации: 4.1.2019
Доброкачественная миоклоническая эпилепсия младенчества
Доброкачественная миоклоническая эпилепсия младенчества (ДМЭМ) – зависящая от возраста форма идиопатической эпилепсии, которая характеризуется генерализованными миоклоническими припадками. Этиология детально не изучена. Патология проявляется мышечными сокращениями верхних конечностей, шеи и головы длительностью в 1-3 сек. с частотою 2-3 раза в день. Общее состояние ребенка и его психофизическое развитие нарушается редко. Диагностика направлена на определение спайк- или полиспайк-волн на ЭЭГ. Основное лечение – медикаментозная монотерапия. Препараты выбора – вальпроаты, при их неэффективности используются бензодиазепины или производные сукцинимида.
Общие сведения
Доброкачественная миоклоническая эпилепсия младенчества (ДМЭМ) – редкая форма эпилепсии в педиатрии. Характерна только для определенной возрастной категории. Впервые заболевание выделено как отдельная нозологическая форма в 1981 году Дарве и Биором. Патология составляет менее 1% от всех форм эпилепсий и порядка 2% от ее идиопатических генерализованных форм. На данный момент в литературе описано около 100-130 случаев данного заболевания. ДМЭМ наблюдается у детей от 6 месяцев до 3 лет, в редких случаях возникает в возрасте до 5 лет. Представители мужского пола болеют в 1,5-2 раза чаще. Патология, как правило, хорошо поддается лечению и полностью купируется в старшем возрасте (в основном – после 6 лет). Осложнения в виде отставания в психомоторном развитии возникают редко и только при отсутствии терапии.
Причины ДМЭМ
Доброкачественная миоклоническая эпилепсия младенчества относится к числу генетически детерминированных заболеваний, передающихся по полигенному типу наследования. Является малоисследованной патологией, поскольку встречается довольно редко. ДМЭМ входит в группу идиопатических генерализованных эпилепсий, однако связи с другими нозологиями из этой группы не установлено. На данный момент неизвестно, мутация каких генов приводит к развитию ДМЭМ.
При сборе семейного анамнеза выясняется, что родители 40% больных страдают или страдали эпилепсией либо фебрильными припадками. Патогенетически развитие миоклонических атак обусловлено возникновением разряда быстрых генерализованных спайк-волн (СВ) или полиспайк-волн (ПСВ). Их частота составляет 3 Гц или более, а длительность – 1-3 сек. Волны формируются в лобных или теменных участках коры головного мозга. Сами атаки могут быть спонтанными или возникающими на фоне определенных (звуковых, тактильных или ритмичных световых) раздражителей.
Симптомы ДМЭМ
ДМЭМ диагностируется в возрасте от 6 месяцев до 3 лет. Развитие ребенка до появления первых миоклонических припадков проходит нормально. Примерно у 20% детей проявляются редкие судороги при рождении или в неонатальном периоде. Общее состояние пациента страдает редко, нарушения неврологического статуса не выявляются. Первые миоклонические атаки поражают верхние конечности, шею и голову, редко – ноги. Они могут иметь разную интенсивность, в том числе – у одного и того же ребенка во время разных эпизодов. Выраженность колеблется от еле заметных подергиваний до видимых фибрилляций.
Частота припадков составляет 2-3 раза в сутки с разными временными интервалами. Длинных серий атак не наблюдается. Возможна провокация атаки громким звуком, тактильной или ритмичной световой стимуляцией. После каждого эпизода может наблюдаться рефрактерный период длительностью от 20 до 120 сек. В этом временном промежутке даже интенсивная стимуляция не вызывает новый приступ. При этом часто наблюдается мышечная атония. Для заболевания характерно усиление миоклонических приступов при засыпании (дремоте) и их исчезновение в фазе медленного сна.
Выделяют рефлекторный и спонтанный варианты ДМЭМ. В первом случае миоклонические приступы развиваются после воздействия триггеров. Спонтанная форма возникает без каких-либо предикторов. На ранних этапах заболевания и при низкой интенсивности миоклоний родители и педиатр могут принимать атаки за нормальные моторные реакции ребенка. Относительно выраженные миоклонические приступы могут сопровождаться наклоном головы вперед, отводящим и приводящим движением, сгибанием рук, редко – плавным вращением глазных яблок. Часто родители отмечают характерное «кивание» головой продолжительностью от 1 до 3 сек., редко – до 10 сек. (у детей старшего возраста). В некоторых случаях единственным клиническим проявлением ДМЭМ становится длительное смыкание глаз.
При тяжелых формах возможна генерализация судорог, сопровождающаяся потерей равновесия, внезапным выпадением предметов из рук, редко – расстройствами сознания. В процесс иногда вовлекаются межреберные мышцы, передняя брюшная стенка и диафрагма, из-за чего нарушается дыхание и может выслушиваться экспираторный шум. Для ДМЭМ характерно увеличение интенсивности клинических проявлений до определенного возраста и их последующее полное исчезновение. При длительном течении заболевания возможно отставание в психомоторном развитии. Трансформация в другие формы приступов, в том числе в абсансы, не происходит даже на фоне отсутствия специфического лечения.
Диагностика ДМЭМ
Диагностика доброкачественной миоклонической эпилепсии младенчества заключается в сборе анамнестических данных и проведении инструментальных методов исследования. Физикальное обследование ребенка в интериктальный период неинформативно. Лабораторные тесты каких-либо отклонений от возрастной нормы не выявляют. Наибольшую диагностическую ценность имеет повторная полиграфическая видеоэлектроэнцефалография (видео-ЭЭГ), которая позволяет обнаружить спайк-волны и доказать наличие миоклонических приступов. При необходимости проводится провокационная проба с ритмической световой или тактильной стимуляцией.
Вне приступов (а изредка – во время них) данные ЭЭГ остаются в пределах нормы, спонтанные спайк-волны возникают редко. Во время медленного сна возможно усиление разрядов в коре головного мозга при сохранении их нормальной структуры, возникновение быстрых ритмов или формальных изменений. В быструю фазу (REM-сон) могут фиксироваться генерализованные разряды спайк-волн. С целью исключения органической патологии могут назначаться нейросонография, компьютерная и магнитно-резонансная томография. При наличии клинической симптоматики на протяжении длительного периода проводится оценка психомоторного развития.
Дифференциальная диагностика ДМЭМ осуществляется с криптогенными детскими судорогами, доброкачественным неэпилептическим миоклонусом, синдромом Леннокса-Гасто и миоклонически-астатической эпилепсией раннего детского возраста.
Лечение ДМЭМ
Лечение ДМЭМ, как правило, проводится в амбулаторных условиях, исключением являются частые и тяжелые миоклонические атаки, требующие постоянного наблюдения. Показана медикаментозная терапия при помощи противоэпилептических средств. Первую линию составляют препараты из группы вальпроатов (натрия вальпроат). Важную роль играет подержание стабильной концентрации действующего вещества в крови. Нерегулярное введение назначенных средств провоцирует новые приступы и формирование резистентности к дальнейшей терапии данным медикаментом. При недостаточной эффективности вальпроатов показаны препараты из группы бензодиазепинов (нитразепам) или производных сукцинимида (этосуксимид). Терапевтический курс предполагает лечение на протяжении 3-4 лет с момента возникновения первых припадков.
При выраженной чувствительности к ритмичным световым раздражителям длительность курса увеличивается. При минимальной активности приступов или их исключительно рефлекторном характере лечение может проводиться в сокращенные сроки или не назначаться вовсе. При рецидиве миоклонических атак в старшем возрасте после пройденного лечения рекомендован упрощенный вариант аналогичного терапевтического курса. Обязательным моментом является психологическая поддержка семьи, непосредственно влияющая на эффективность лечения и направленная на исключение триггеров для ребенка.
Прогноз и профилактика ДМЭМ
Специфической профилактики для доброкачественной миоклонической эпилепсии младенчества не разработано. Прогноз в большинстве случаев благоприятный, заболевание, как правило, заканчивается полным выздоровлением ребенка. Миоклонические атаки, возникающие на фоне звуковой или тактильной стимуляции, прогностически более благоприятны, чем спонтанные. Переход в другие формы эпилепсии нехарактерен. Острый период, при котором наблюдаются выраженные припадки, в среднем длится менее 12 месяцев. Более чем у 53% детей в возрасте 6 лет все симптомы ДМЭМ полностью исчезают. Примерно у 14% в дальнейшем наблюдаются задержка психического развития или нарушения в поведении, из-за чего пациенты вынуждены получать образование в специализированных учебных заведениях. Частота осложнений напрямую зависит от своевременности диагностики, эффективности проводимого лечения и психологического климата в семье, в первую очередь – взаимоотношений между ребенком и матерью.
Миоклоническая эпилепсия раннего детского возраста
Что провоцирует / Причины Миоклонической эпилепсии раннего детского возраста:
Миоклоническая эпилепсия раннего детского возраста относится к идиопатическим формам. Этиология неизвестна, но часто имеется семейный анамнез судорог или эпилепсии.
Симптомы Миоклонической эпилепсии раннего детского возраста:
Возраст начала развития миоклонической эпилепсии раннего детского возрастачаще наступает в 1-2 года.
Припадки носят характер очень кратковременных генерализованных миоклоний.
Психика чаще без изменений, может наблюдаться некоторое запаздание интеллектуального развития.
Диагностика Миоклонической эпилепсии раннего детского возраста:
Дифференциальная диагностика
Миоклонии детского возраста всегда составляют значительные сложности в дифференциально-диагностическом плане, так как нередко встречаются даже в норме. Физиологические миоклонии наблюдаются во сне практически у всех здоровых людей.
Эпилептические миоклонии позволяет дифференцировать ЭЭГ.
Прогноз
Как правило, очень благоприятный. Приступы хорошо реагируют на лечение, но в подростковом возрасте могут встречаться ГТКП (генерализованные тонико-клонические приступы).
Лечение Миоклонической эпилепсии раннего детского возраста:
Вальпроаты (депакин, орфирил и др.).
К каким докторам следует обращаться если у Вас Миоклоническая эпилепсия раннего детского возраста:
Миоклония
Миоклонии – это непроизвольные движения, быстрые отрывистые сокращения отдельных мышц или их групп. Обычно вовлекается мускулатура конечностей, туловища или лица без потери сознания. Миоклонии бывают физиологическими или патологическими, развитие которых связывают с эпилепсией, дегенеративными и инфекционными заболеваниями, метаболически-гипоксическими нарушениями. Диагностика проводится клиническими, лабораторными и инструментальными методами (МРТ, ЭЭГ). Лечение предполагает устранение обратимых состояний и поддерживающую терапию.
Причины миоклонии
Физиологические процессы
Иногда мышечные подергивания считаются вариантом нормы. Физиологические миоклонии чаще всего наблюдаются при засыпании и в ранней фазе сна (гипнагогические), особенно после физического или эмоционального переутомления. В зависимости от степени вовлечения мускулатуры они бывают фокальными, мультифокальными, генерализованными. У детей до полугода такие движения могут возникнуть при кормлении или во время игры.
Быстрые и короткие сокращения мышц провоцируются внезапными раздражителями – световыми, звуковыми, двигательными. В сочетании с вегетативными изменениями (потливостью, учащенным сердцебиением, одышкой) они напоминают реакцию испуга. Другой распространенной ситуацией является диафрагмальная миоклония или икота, возникающая при раздражении блуждающего нерва от заглатывания воздуха или быстрой еды.
Миоклонус-эпилепсия
Миоклонические приступы входят в клиническую картину различных форм эпилепсии. При этом выделяют несколько путей их развития с учетом локализации первичного очага возбуждения в ЦНС – кортикальный, таламокортикальный, с неизвестным механизмом. Патологическая импульсация из коры моторных зон головного мозга характерна для следующих миоклоний:
Для большинства прогрессирующих миоклонус-эпилепсий характерно аутосомно-рецессивное наследование. Это обширная группа заболеваний, в которую входят болезни накопления (Гоше, нейрональный липофусциноз, GM2-ганглиозидоз), болезнь Лафоры, Унферрихта-Лундборга. Также к ним относят сиалидоз и дентарубро-паллидольюисову атрофию.
Клиническая картина миоклонус-эпилепсий разнообразна. Наряду с быстрыми спонтанными подергиваниями в дистальных отделах конечностей наблюдаются парциальные и генерализованные приступы (клонические, тонико-клонические), абсансы. Выраженная кортикальная миоклония сопровождается мозжечковыми расстройствами, может привести к обездвиживанию пациента.
Доброкачественная миоклония младенческого возраста – это такое состояние, единственным симптомом которого становятся подергивания в плечевом поясе, идущие изолированно или сериями. Подобные пароксизмы могут сопровождаться одновременным снижением тонуса мышц шеи, что описывается как быстрый кивок головой. Некоторые из этих приступов провоцируются прикосновением.
Дегенеративные заболевания
Миоклонические приступы встречаются при дегенеративном поражении подкорковых структур ЦНС, отвечающих за регуляцию непроизвольных движений. Их описывают как непостоянный признак у лиц, страдающих деменцией с тельцами Леви (ДТЛ), хореей Гентингтона, прогрессирующим надъядерным параличом. Схожие проявления наблюдают при болезни Паркинсона, Альцгеймера, мозжечковой миоклонической диссинергии Ханта.
Миоклонии при ДТЛ – довольно частая форма двигательных нарушений. Для заболевания характерны симптомы паркинсонизма в виде тремора пальцев, замедленности движений и постуральной неустойчивости. Отмечаются прогрессирующие когнитивные нарушения, рано развиваются зрительно-пространственные, вегетативные, нейропсихиатрические расстройства (галлюцинации, делирий, депрессия).
Церебральная гипоксия
Распространенные миоклонии возникают на фоне гипоксического повреждения головного мозга. Причиной могут быть остановка сердца, коматозные состояния, отравление угарным газом. После глубокой гипоксии из-за тяжелого приступа удушья, асфиксии или инфаркта миокарда наблюдаются кинетические миоклонусы, описанные как синдром Ланса-Адамса. В его развитии предполагается роль корковой и стволовой дисрегуляции моторных функций.
Для гипоксического поражения мозга характерны интенционные миоклонии – нерегулярные подергивания мышц, которые усиливаются при достижении цели (на фоне выполнения пальценосовой или пальцемолоточковой пробы). Они наблюдаются только в конечности, совершающей быстрое движение. При медленных действиях патологические сокращения обычно отсутствуют.
Инфекционная патология
Развитие миоклоний связывают с нейроинфекциями вирусной природы: летаргическим, герпетическим, клещевым энцефалитом. В последнем случае отмечают фокальную эпилепсию Кожевникова. Она проявляется типичным миоклонусом, сочетающимся с фокальными или вторично генерализованными судорожными приступами, очаговыми неврологическими симптомами (центральным гемипарезом), расстройствами психики.
Кортикальные миоклонии при кожевниковской эпилепсии затрагивают строго определенные мышечные группы. Они постоянны и не исчезают во сне, характеризуются ритмичностью и стереотипностью, усиливаются при волнении и целенаправленных движениях. Обычно такие подергивания развиваются только в одной руке, реже вовлекается половина лица на той же стороне.
Еще одна причина пароксизмов – подострый склерозирующий панэнцефалит. Болезнь проявляется подергиваниями конечностей, головы и туловища, резкими сгибательными движениями по типу кивков, множественными дискинезиями. Далее присоединяются смешанные судороги, парезы и параличи. На поздних стадиях возникает децеребрационная ригидность, нарушения глотания и дыхания, слепота.
Метаболические расстройства
Частой причиной миоклонии становятся дисметаболические состояния. Они обусловлены нарушением биохимических и энергетических процессов в моноаминергических нейронах базальных ядер и мозговой коры. Генерализованные миоклонии мышц описаны при уремии, печеночной недостаточности, электролитных нарушениях (гипокальциемии, гипонатриемии, гипомагниемии). Мышечными подергиваниями проявляются гипогликемия и некетонемическая гипергликемия.
Интоксикации и передозировка лекарств
Прямое нейротоксическое действие химических веществ обусловлено нарушением образования и проведения импульса, модификацией пластического и энергетического обменов. Опосредованное влияние реализуется через дисфункцию внутренних органов, отвечающих за экскрецию и детоксикацию. Как проявление острой интоксикации миоклонии возникают при отравлениях тяжелыми металлами (включая висмут), ДДТ, бромистым метилом.
Ятрогенные миоклонии мышц обусловлены передозировкой медикаментов. Сочетание с экстрапирамидными и мозжечковыми симптомами типично для приема препаратов лития, нейролептиков, трициклических антидепрессантов. Причиной подергиваний бывают бензодиазепины, антигистаминные средства, антиконвульсанты. Сходные эффекты описаны для пенициллина и цефалоспоринов.
Диагностика
Мышечные сокращения выявляются на основании клинического обследования с неврологическим осмотром. Подтвердить причину миоклоний врачу-неврологу помогают результаты дополнительных исследований. Учитывая этиологическое разнообразие патологии, сопровождающейся такими приступами, в схемах диагностики могут присутствовать различные процедуры:
Лечение
Консервативная терапия
Терапия проводится преимущественно консервативными методами, объем и характер медицинской помощи определяются конкретной ситуацией. Доброкачественные миоклонии не требуют лечения, в тяжелых случаях необходима активная комплексная коррекция. Основу лечения составляют медикаменты, действие которых реализуется по нескольким направлениям:
При неэффективности противосудорожных средств рассматривается вопрос о назначении кетогенной диеты. Для устранения уремии или выраженной химической интоксикации показаны экстракорпоральные методы – гемодиализ, плазмаферез, гемосорбция. Реабилитация пациентов с энцефалопатиями предполагает гипербарическую оксигенацию, церебральную гипотермию, рефлексотерапию.
Хирургическое лечение
Для лечения кортикальных миоклоний, резистентных к медикаментам, предлагают нейрохирургическое вмешательство в объеме функциональной гемисферэктомии. Некоторые фокальные приступы нуждаются в радикальном устранении грубых органических причин – опухоли или ангиомы. При болезни Унферрихта-Лундборга и синдроме Леннокса-Гасто рекомендуют стимуляцию блуждающего нерва.