Митозы что это при гистологии матки
Митозы что это при гистологии матки
При изучении митотического режима эндометрия у 30 больных до и после лечения выявлено исчезновение патологических митозов у всех больных с различными видами гиперплазии эндометрия. Результаты сравнительного изучения влияния на эндометрий комбинированных эстроген-гесгатенных препаратов, принимаемых в течение 21 дня, и «чистых» гестагенов, которые назначались только во второй половине менструального цикла, свидетельствовали об одинаково высокой эффективности этих препаратов в отношении нормализации состояния эндометрия и частоты восстановления генеративной функции у данных больных.
После лечения синтетическими прогестинами наблюдалась нормализация состояния эндометрия у 4 из каждых 5 больных. Лечение прерывистыми курсами синтетическими прогестинами позволило восстановить генеративную функцию у 40,2% больных с дисфункциональными маточными кровотечениями ановуляторного характера в детородном возрасте. Все это дает основание считать целесообразным назначение больным с дисфункциональными маточными кровотечениями в детородном возрасте прерывистых курсов комбинированных эстроген-гестагенных препаратов или «чистых» гестагенов.
Последние обладают большим преимуществом, так как, не уступая по эффективности комбинированным препаратам, они не вызывают таких осложнений, как тромбофлебиты, обострения хронических заболеваний печени, желудка, гипертонической болезни, которые, согласно нашим данным, наблюдаются при применении инфекундина и других препаратов в 30% случаев.
Отдаленные результаты влияния гормонального лечения на состояние органов-мишеней нами изучены у 150 женщин с дисфункциональными маточными кровотечениями и олигоменореей. Эти больные были разделены на две группы: первую составили 58 больных, получавших систематически циклическую гормональную терапию или синтетические прогестины, вторую — 92 больные, не лечившиеся препаратами половых гормонов или получавшие гормоны бессистемно.
Сравнение состояния эндометрия у больных этих групп показало, что при отсутствии гормонального лечения гиперпластические процессы в эндометрии наблюдаются почти в 3 раза чаще, чем у леченых больных (в 61,7±4,9% и 23,4±4,9% соответственно). Подобная зависимость выявлена и в отношении молочных желез: аналогичные показатели составили 71,6±4,6% и 46,6 ±5,8% [Мануйлова И. А., Фролова Р. А.].
Обнаруженная нами прямая зависимость между частотой развития предраковых изменений в эндометрии и молочных железах у больных с расстройствам менструального цикла и большой продолжительностью заболевания, а также обратное их развитие при своевременной коррекции нарушенных гормональных взаимоотношений дает возможность определить конкретные шути профилактики этих патологических изменений в гормональнозависимых органах.
Можно считать, что в последние годы стерлась грань между функциональными и некоторыми органическими заболеваниями половой системы. Функциональные нарушения часто являются предстадией многих органических заболеваний в гормонально-зависимых органах. Наряду с этим установлена положительная взаимосвязь между ановуляцией или длительной только эстрогенной терапией свыше 2 лет и частотой аденокарциномы эндометрия [McKay].
Функциональные нарушения у женщин, как правило, проявляются в виде ановуляции, которая сопровождается относительным увеличением эстрогенов и отсутствием циклической секреции ЛГ с последующей ановуляцией на фоне недостатка прогестерона, что приводит к развитию гиперпластических процессов в гормонально-зависимых органах.
Исследования, проведенные на клеточном уровне, показали, что гиперпластические процессы сопровождаются нарушением процесса деления клеток как в количественном, так и в качественном отношении, что может приводить в случае прогрессирования заболевания к появлению атипичных клеток, характерных даже для ракового процесса. Однако если исходить из современной концепции механизма канцерогенеза, остается неясным, является ли ановуляция начальным или ускоряющим или тем и другим фактором в развитии рака эндометрия [King].
Наряду с этим выявляются перспективность дальнейшего изучения эндокринных аспектов кинетики канцерогенеза эндометрия, а также необходимость профилактического назначения гестатенов больным с ановуляторными дисфункциональными кровотечениями, которые составляют группу повышенного риска в отношении развития злокачественных опухолей и диспансерного наблюдения за ними.
Все сказанное даст основание полагать, что своевременное лечение больных с дисфункциональными нарушениями, а также с воспалительными заболеваниями гениталий, часто сопровождающимися ановуляцией, может значительно снизить частоту развития органических заболеваний молочных желез и гениталий. Это приведет не только к уменьшению количества хирургических вмешательств, но и к сохранению генеративной функции и здоровья многих женщин.
Онкологические аспекты гиперпластических процессов эндометрия
Гиперплазия — это увеличение количества клеток без увеличения их размеров. Гиперпластические процессы могут предшествовать развитию онкологического заболевания. Гиперплазия эндометрия — одна из форм патологических пролиферативных изменений эндометрия, с преимущественной пролиферацией железистого компонента по сравнению со стромальным компонентом [1].
Существует гистологическая классификация гиперпластических процессов эндометрия, предложенная ВОЗ (2014) [2]:
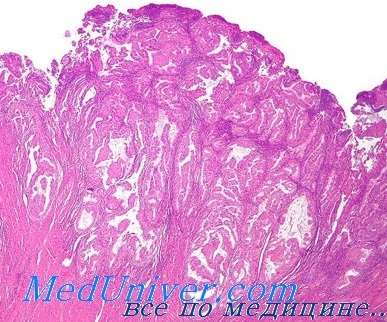
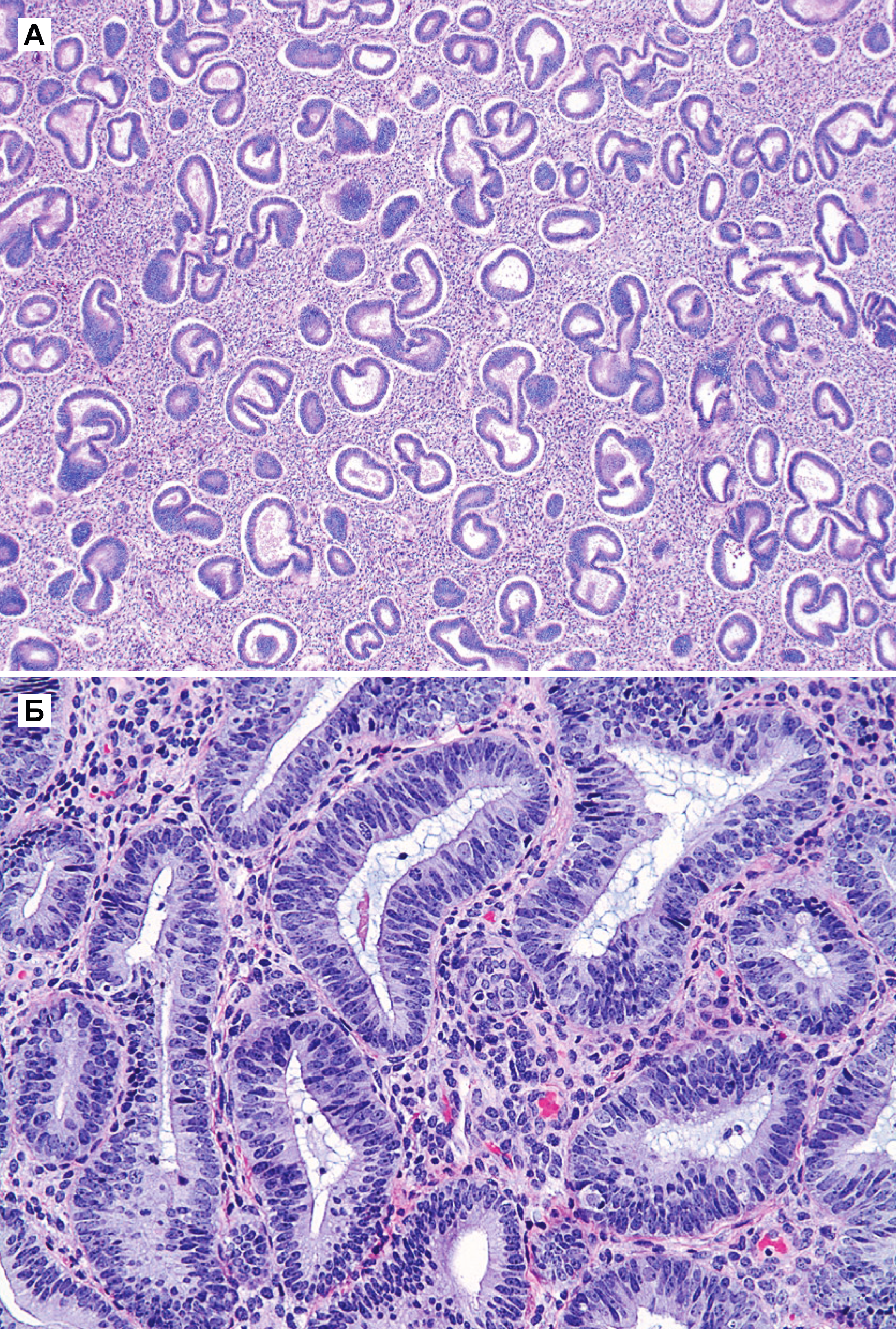
Гиперплазия эндометрия без атипии — это пролиферация с изменением строения желез и клеток, но без клеточной атипии. Изменения в строении обычно видны при малом увеличении, но важной особенностью, которая определяет прогноз и возможность малигнизации — это клеточная атипия. Все типы гиперплазии характеризуются увеличением отношения железы к строме, неравномерностью формы железы и изменением размера железы (рис. 1 а и б). При гиперплазии без атипии железистый эпителий напоминает пролиферирующий эндометрий (рис. 1 б). Клетки столбчатые с амфофильной цитоплазмой и имеют псевдостратифицированные ядра, ориентированы к базальной мембране и имеют овальную форму с гладкими контурами, равномерно распределенный хроматин и небольшие незаметные ядрышки. Митотическая активность может быть переменной и может быть меньше, чем в пролиферирующем эндометрии. Частота митоза не влияет на диагноз [5].
Как правило, гиперплазия диффузная, но может быть очаговой из-за локальных различий в содержании рецепторов эстрогена и прогестерона в эндометрии. При простой гиперплазии присутствует строма в значительном объеме. Строение стромы напоминает нормальное, характерное для пролиферативной фазы, строма состоит из маленьких овальных клеток со скудной цитоплазмой. Как и в железах, в строме отмечена митотическая активность. Когда гиперплазия является полипоидной, строма может содержать артерии с толстой стенкой, подобные тем, которые наблюдаются в полипах. По мере прогрессирования гиперплазии железы располагаются более тесно. Обычно железы плотно прилегают друг к другу, хотя всегда присутствует небольшое количество стромы между ними [5].
К предраковым заболеваниям эндометрия относятся [2]:
Эндометрий — мишень половых гормонов, так как эта ткань имеет специфические рецепторы. Клетки эндометрия обновляются ежемесячно под влиянием гормональной регуляции. Нарушение гормонального статуса женщины может изменять рост и дифференцировку клеток. Поэтому могут возникнуть гиперпластические процессы [2].
Атипичная гиперплазия отличается наличием ядерной атипии и сложным строением с тесно расположенными железами. Железы обычно неправильной формы и размера. Каждая железа имеет базальную мембрану, окруженную тонким слоем стромы, отделяющей его от соседних желез. Однако в некоторых случаях железы расположены далеко друг от друга. Встречаются как железы без клеточной атипии, так и атипичные [5].
Специфические особенности при атипичной гиперплазии включают: стратификацию, увеличение размера ядер с измененным хроматином и ядрышками. В ядрах отмечена истинная стратификация (2–4 слоя), и потеря ориентирования к базальной мембране [5].
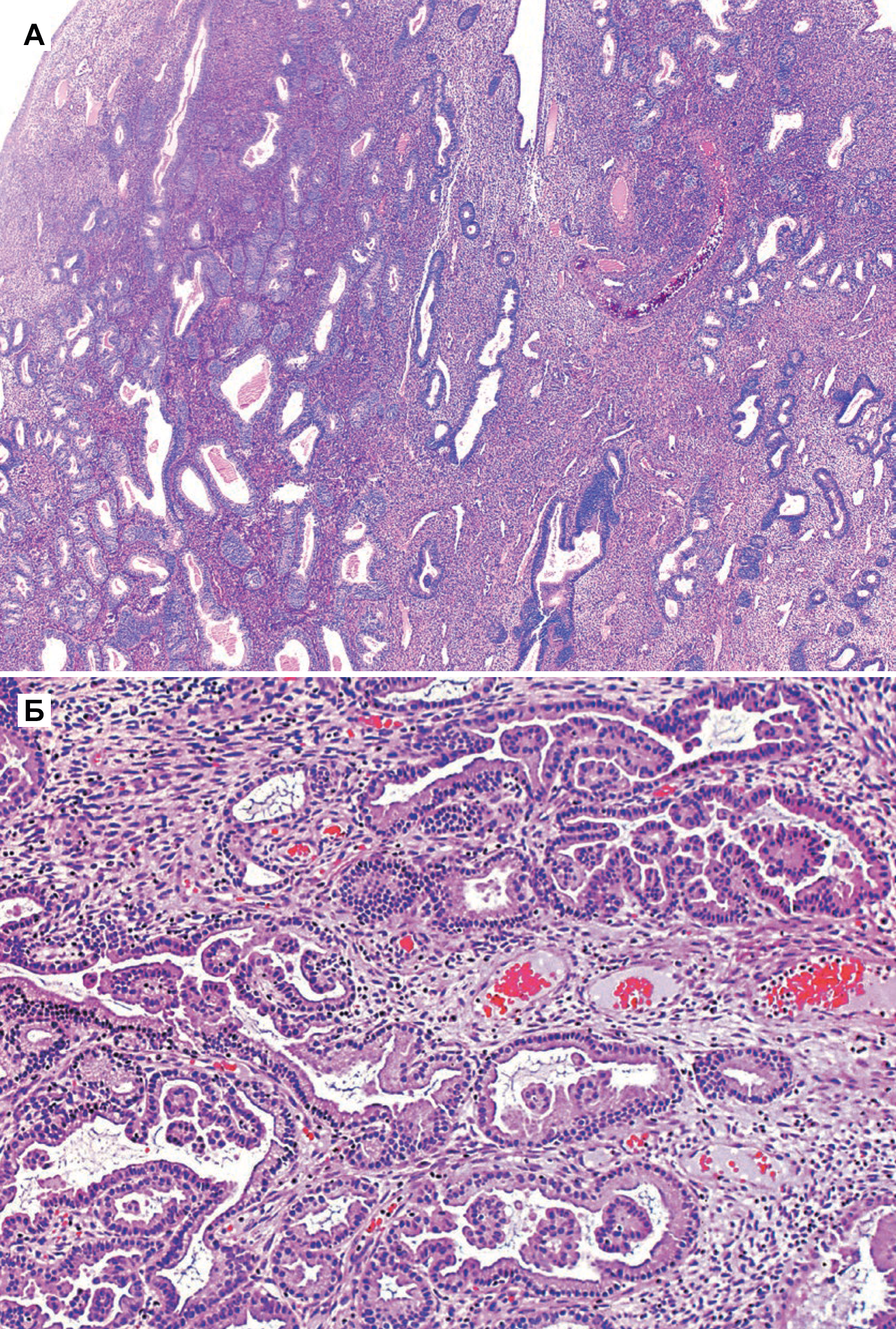
На фоне гиперпластических процессов в эндометрии, возникающих при длительной пролиферации желез эндометрия без перехода их в секреторную фазу, может развиваться рак тела матки (РТМ) — это злокачественная опухоль, происходящая из слизистой оболочки тела матки (эндометрия). Чаще всего РТМ носит спорадический характер, и в 5 % случаев РТМ ассоциирован с наследственными синдромами, например, с синдромом Линча. Среди факторов риска: гиперэстрогения, ранние менархе, отсутствие родов в анамнезе, поздняя менопауза, возраст старше 55 лет, применение тамоксифена [3].
Эпидемиология РТМ
РТМ — самая частая злокачественная опухоль женских половых органов в развитых странах и вторая по частоте после рака шейки матки злокачественная опухоль женских половых органов в мире. В США в 2015 г. зарегистрировано более 54800 новых случаев заболевания РТМ, и более 10150 смертей от этого заболевания. В России ежегодно регистрируется более 21 тысячи больных РТМ. В структуре заболеваемости женского населения в России в 2016 г. РТМ занимал 3-е ранговое место (7,7 %). Средний возраст заболевших РТМ в России составляет 62,6 года [3,4].
Патогенез
Развитие РТМ обусловлено гиперэстрогенией, основной причиной которой является нарушение овуляции. Клиническое изучение метаболических нарушений у больных раком тела матки и морфологические особенности рака эндометрия позволили обосновать концепцию о двух основных патогенетических вариантах заболевания [2].
I тип (более частый). Опухоль развивается в более молодом возрасте, в отличие от пациенток II патогенетического варианта, на фоне длительной гиперэстрогении и гиперплазии эндометрия. У больных РТМ I патогенетического типа часто наблюдаются ожирение, сахарный диабет и гипертоническая болезнь, возможны эстрогенсекретирующие опухоли яичников или синдром склерокистозных яичников. Опухоли I патогенетического варианта, как правило, высокодифференцированные, имеют более благоприятный прогноз [2].
II тип. Опухоли эндометрия обычно низкодифференцированные, имеют менее благоприятный прогноз. Опухоли II патогенетического типа возникают в более старшем возрасте, в отсутствие гиперэстрогении, на фоне атрофии эндометрия. Примерно у 80% больных РТМ диагностируют эндометриоидную аденокарциному [2].
Выделяют три степени дифференцировки аденокарциномы эндометрия [2]:
G1 — высоко дифференцированная;
G2 — умеренно дифференцированная;
G3 — низко дифференцированная или недифференцированная.
Клиника
Ранний симптом прогрессирования рака эндометрия — появление жидких водянистых белей, нередко с примесью крови, и зуда наружных половых органов. Кровянистые выделения из половых путей бывают в виде мажущих серозно-кровянистых выделений, которые становятся порой обильными. Кровотечение, как правило, контактное или появляется после физической нагрузки [2].
Возможны боли внизу живота, которые на ранних стадиях рака носят схваткообразный характер. Это связано с сокращениями эндометрия и опорожнением матки от скопившейся в ней крови или гноевидной жидкости (гематометра, пиометра), отток которой в результате обтурации внутреннего зева затруднен. После таких схваткообразных болей появляются обильные выделения из матки — гной и кровь. При поздних стадиях боли постоянные, особенно интенсивные по ночам, связаны со сдавлением раковым инфильтратом нервных сплетений в малом тазу. При переходе процесса на мочевой пузырь и прямую кишку появляются симптомы нарушения функционирования этих органов [2].
Хирургическое вмешательство рекомендуется как наиболее эффективный метод лечения РТМ независимо от стадии как самостоятельно, так и в комбинации с другими методами [6].
Список литературы:
Атипическая гиперплазия эндометрия
При атипической гиперплазии внутренний слой матки — эндометрий —разрастается, что ведет к увеличению его толщины и объема. При этом морфология клеток изменяется, появляются атипичные — клетки, изменившие свои свойства. Вид и особенности таких клеток становятся нехарактерными тем, из которых они появились. Заболевание может развиваться у женщин любой возрастной категории, но вероятность ее появления выше в постменопаузе.
Это гинекологическое заболевание относится к предраковым состояниям, если адекватное лечение отсутствует, то болезнь в 40% переходит в злокачественную форму. Появление эндометрия с атипической железистой гиперплазией может означать начало преобразования в аденокарциному — злокачественное заболевание. Появление атипичных клеток в функциональном слое слизистой характерно для начального этапа атипической гиперплазии эндометрия матки, их обнаружение в базальном слое и строме — признак начинающегося рака эндометрия.
Как появляется заболевание
Развитие заболевания тесно связано с уровнем гормонов в организме. У здоровой женщины функциональный слой эндометрия увеличивается в 1-й половине цикла. Когда зачатия не наступает, происходит его отторжение, затем он естественным путем удаляется из матки. При гормональных отклонениях этот процесс нарушен, происходит активное деление клеток, однако своевременного отторжения и выведения частиц эндометрия нет. Наблюдается его утолщение и разрастание. Патологические очаги могут появляться на отдельных участках или же избыточное разрастание будет равномерным. Когда все же происходит отторжение эндометрия, появляется обильное кровотечение.
Гиперплазия — прогрессирующее заболевание, со временем свойства эндометрия изменяются, что способствует появлению нехарактерных клеток, развивается атипическая гиперплазия эндометрия. Однако существуют факторы, увеличивающие вероятность появления заболевания:
К группе риска относятся женщины с лишним весом. Сахарный диабет, гипертония также увеличивают риск развития заболевания.
Симптомы
Основным признаком атипической гиперплазии эндометрия является кровотечение. Более продолжительные, чем менструация, нередко продолжающиеся около 3-х недель, кровотечения могут быть цикличными (чаще у женщин репродуктивного возраста) или ацикличными. Не отделившиеся частицы эндометрия могут стать причиной межменструальных выделений. Нередко кровотечения возникают после задержки; после незначительной — выделения носят умеренный характер, после длительной — они становятся обильными. У четверти пациенток возникают ановуляторные кровотечения — нерегулярные, большей продолжительности и кровопотери.
Отсутствие лечения приводит к осложнениям. В результате длительных и обильных кровотечений развивается анемия. К наиболее тяжелым последствиям атипической гиперплазии эндометрия относится переход болезни в рак.
Однако заболевание не всегда сопровождается характерными признаками, при бессимптомном течении женщина может долго и безуспешно пытаться забеременеть. Гиперплазия эндометрия в таком случае впервые диагностируется, когда женщина обращается к врачу по поводу бесплодия.
Диагностика
Чтобы своевременно обнаружить болезнь даже при бессимптомном течении, важно регулярно проходить гинекологическое обследование даже при отсутствии каких-либо жалоб. В настоящее время существуют различные методики, позволяющие безошибочно диагностировать заболевание даже на ранней стадии. Сюда входят:
Для уточнения диагноза также может быть рекомендовано проведение МРТ, назначено обследование у эндокринолога, что важно для пациенток, входящих в группу риска. Комплексное обследование позволяет обнаружить не только атипическую гиперплазию эндометрия, но и диагностировать другие заболевания: как половой сферы (миому, кисты яичников и т.п.), так и другие отклонения (сахарный диабет, гипертонию и др.).
Лечение
Выбор тактики лечения при атипической гиперплазии эндометрия зависит от возраста пациентки, тяжести состояния, наличия сопутствующих заболеваний, осложнений, а также желания женщины сохранить функцию репродукции. Лечение может быть консервативным или хирургическим.
При консервативной терапии назначаются гормональные препараты, направленные на подавление разрастания эндометрия, нормализацию цикла, восстановление гормонального баланса. При наличии кровотечений показано выскабливание эндометрия во время гистероскопии.
Хирургическое лечение — какие существуют варианты
Операция при атипической гиперплазии эндометрия назначается, если:
Не так давно единственным методом лечения было удаление матки. Я выполняю радикальную операцию в том случае, если патоморфологически подтвержден рак эндометрия, в остальных ситуациях возможно проведение органосохраняющего вмешательства.
Одним из эффективных методов является гистерорезектоскопия, рекомендованная женщинам репродуктивного возраста или в пременопаузальном периоде. Процедура относится к малотравматичным и выполняется с использованием эндоскопического оборудования, оснащенного видеокамерой. Возможность визуализации позволяет проводить манипуляции максимально бережно и с высокой точностью, без риска развития осложнений. Длительность процедуры — около получаса, период восстановления занимает не более 14 дней.
Однако для проведения гистерорезектоскопии, как и при любом хирургическом вмешательстве, имеются противопоказания:
При лечении гиперплазии неплохо зарекомендовала себя малоинвазивная процедура — абляция — трансцервикальная деструкция эндометрия. Во время ее проведения можно удалить базальный и функциональный слой эндометрия, а также часть миометрия на глубину 3-5 мм. Абляция может быть проведена с помощью лазерной или электрохирургической методики, но в любом случае процедура выполняется с использованием гистероскопического оборудования, поэтому является безопасной и эффективной.
При наступлении менопаузы женщине рекомендована гистерэктомия — удаление матки. Если патологические изменения в яичниках отсутствуют, то операция проводится без удаления придатков. В случае, если имеется аденомиоз или подтвержден злокачественный процесс в матке, то гистерэктомия проводится с удалением придатков. Органуносящая операция также показана пациенткам в постменопаузе при рецидиве после гормонального лечения.
Мною проведено более 4000 гинекологических операций, в том числе по поводу гиперплазии эндометрия. К каждой пациентке я подбираю тактику лечения, учитывая целый ряд деталей: возраст и наличие других болезней, желание сохранить матку как орган и проведенное ранее лечение. Если существует возможность, я всегда стремлюсь провести малотравматичную органосохраняющую операцию, после которой женщина сможет быстро вернуться к привычному образу жизни. После такой операции восстановление занимает не более двух недель, а госпитализация не превышает трех дней.
Сегодня возможность сохранить матку имеется даже у пациенток с сопутствующими гинекологическими заболеваниями (например, с миомой, кистами, полипами). Однако проведение органосохраняющей операции окажется невозможным, если процесс перейдет в злокачественный. Чтобы избежать подобного, следует регулярно проходить осмотры. В нашей клинике даже полное обследование займет минимум времени.
Митозы что это при гистологии матки
ГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава РФ; ГБОУ ДПО «Российская медицинская академия последипломного образования», Москва
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздравсоцразвития России
Московский научно-исследовательский онкологический институт им. П.А. Герцена Росмедтехнологий, Москва
«Доброкачественная метастазирующая лейомиома» тела матки
Журнал: Архив патологии. 2012;74(6): 38-42
Андреева Ю. Ю., Данилова Н. В., Шикеева А. А., Кекеева Т. В., Завалишина Л. Э., Франк Г. А. «Доброкачественная метастазирующая лейомиома» тела матки. Архив патологии. 2012;74(6):38-42.
Andreeva Yu Yu, Danilova N V, Shikeeva A A, Kekeeva T V, Zavalishina L É, Frank G A. Benign metastatic leiomyoma of the corpus uteri. Arkhiv Patologii. 2012;74(6):38-42.
ГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России
ГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава РФ; ГБОУ ДПО «Российская медицинская академия последипломного образования», Москва
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздравсоцразвития России
Московский научно-исследовательский онкологический институт им. П.А. Герцена Росмедтехнологий, Москва
Лейомиома тела матки — самая распространенная гинекологическая опухоль у женщин репродуктивного возраста [1]. Доброкачественная метастазирующая лейомиома (ДМЛ, код ICD.0-8898/1) — редкий феномен, характеризующийся множественными доброкачественными лейомиомами (метастазами) в органах и тканях у пациенток, имеющих лейомиому матки, при отсутствии данных о другом опухолевом процессе [2].
Чаще всего очаги ДМЛ встречаются в легких [3], но могут выявляться в забрюшинном пространстве, полости малого таза [4], сердце [5], нижней полой вене [6], лимфатических узлах забрюшинного пространства и малого таза [7], большом сальнике, правом предсердии, мышцах конечностей [8], черепе [9], молочной железе [10]. Однако множественные очаги опухоли в лимфатических узлах при ДМЛ встречаются редко и в литературе имеются крайне скудные данные о прогнозе и лечении больных с метастазами ДМЛ в лимфатических узлах.
ДМЛ характеризуется низкой митотической активностью, отсутствием ядерного полиморфизма и признаков инвазии, за исключением множественных отдаленных поражений (метастазов), длительным течением. Метастазы представляют собой активно растущие опухоли, чаще всего возникающие у женщин репродуктивного возраста, имеющих лейомиому матки на момент их обнаружения или в анамнезе [11]. Поскольку локализация данных опухолей различна, то терминология варьирует от диссеминированного перитонеального лейомиоматоза (при лейомиомах в брюшной полости и полости малого таза) до интравенозного лейомиоматоза (при лейомиомах в полостях сосудов и сердца).
Факторы риска определены нечетко, однако имеются данные о том, что большинство пациенток до обнаружения метастазов подвергались диагностическому выскабливанию, миомэктомии или гистерэктомии, которые рассматриваются как предрасполагающий фактор к развитию ДМЛ. Другим подтверждением теории метастазирования является то, что лейомиома легких встречается крайне редко и, кроме того, при ДМЛ в легких опухоли имеют рецепторы эстрогенов и регрессируют под воздействием лечения [2].
Патогенез ДМЛ остается неясным, однако предполагается, что он сходен с патогенезом эндометриоза [12]. Данное заболевание часто возникает у женщин репродуктивного возраста и тесно связано с гормональной стимуляцией. Поэтому такие звенья патогенеза эндометриоза, как гормональная стимуляция, лимфогенное и гематогенное распространение, целомическая метаплазия и интраперитонеальная имплантация, можно применить для объяснения ДМЛ.
Гормональная стимуляция. В части случаев ДМЛ в опухоли были обнаружены рецепторы не только эстрогенов, но и прогестерона, и лютеинизирующего гормона [11, 13, 14]. Отмечается увеличение распространенности ДМЛ при воздействии эстрогенов или повышенном эндогенном уровне эстрогенов [15, 16], во время беременности описан регресс опухоли [17]. Регрессия опухоли наблюдалась после оофорэктомии [11], в менопаузе [18], при использовании агонистов гонадотропин- и рилизинг-гормона [19], мегестрола [20], ингибиторов ароматазы Р-450 и селективных модуляторов эстрогенов [11]. Однако в редких случаях ДМЛ возникала у женщин репродуктивного возраста, не получавших заместительную гормональную терапию [21]. Таким образом, теория гормональной стимуляции не может объяснить все случаи возникновения ДМЛ.
Перитонеальное распространение. В последние 3 года появилось много сообщений о ДМЛ, возникающих после диагностического выскабливания полости матки, лапароскопической или абдоминальной миомэктомии и гистерэктомии по поводу лейомиомы тела матки [22]. Возможно, фрагменты лейомиомы матки имплантируются в области места стояния лапаропорта при извлечении опухоли или закрепляются на стенках брюшной полости и полости малого таза при кусковании опухоли. Данная теория может объяснить лишь случаи перитонеального лейомиоматоза.
Лимфогенное и гематогенное распространение. Возможно, фрагменты лейомиомы попадают в венозное русло или лимфатические сосуды в процессе хирургической операции и в дальнейшем распространяются в другие органы [7, 22].
Целомическая метаплазия. Диссеминированный перитонеальный лейомиоматоз может быть представлен поражениями, происходящими из субмезотелиальной мезенхимы [4]. Вероятно, данные опухоли возникают из субцеломических мезенхимальных клеток, которые дифференцируются в миобласты под влиянием гормональных факторов [22].
Клиническая характеристика
ДМЛ часто протекает бессимптомно и обнаруживается случайно при лапаротомии, лапароскопии, ультразвуковом исследовании или рентгенографии. Пациентки редко предъявляют жалобы на дискомфорт в области живота, кровянистые выделения из половых путей, некоторые самостоятельно обнаруживают объемные образования в брюшной полости. Большинство пациенток имеют в анамнезе лейомиому матки, миомэктомию или гистерэктомию по поводу лейомиомы [3, 22].
Гистологическая характеристика
Для подтверждения диагноза ДМЛ необходима биопсия. Размер узлов, как правило, варьирует от 0,5 до 50 мм. Опухоли плотные, четко отграничены от окружающих тканей, на разрезе белесоватого цвета, волокнистого вида [14]. Гистологически ДМЛ представляет собой типичную или клеточную лейомиому, для которой характерна пролиферация гладкомышечных клеток, иногда с единичными митозами, минимальной ядерной атипией, отсутствием очагов некроза [23]. В составе узлов могут встречаться фибробласты, децидуальные клетки и редко — эндометриальные стромальные клетки [15].
При иммуногистохимическом исследовании выявляются маркеры гладкомышечных клеток — десмин, гладкомышечный актин, мышечно-специфический актин, кальдесмон, а также виментин, рецепторы эстрогенов, прогестерона и лютеинизирующего гормона [13, 24].
Рецидивирование и малигнизация
ДМЛ является доброкачественной опухолью, характеризуется медленным ростом, однако имеет потенциальный риск рецидива и озлокачествления. Иногда рецидив возникает в менопаузе, несмотря на предыдущую оофорэктомию [15]. Описаны случаи выполнения повторной лапаротомии по поводу рецидива ДМЛ [25]. Во всех случаях ДМЛ прогрессирование или рецидив в течение 1-го года должен рассматриваться как возможный признак малигнизации [15]. При адекватном лечении ДМЛ имеет благоприятный прогноз [26].
Дифференциальная диагностика
ДМЛ необходимо дифференцировать от лейомиосаркомы — крайне агрессивной опухоли, которая составляет до 5% всех злокачественных новообразований матки [27—29]. Основными критериями для постановки диагноза лейомиосаркомы матки является высокая митотическая активность (не менее 6 митозов в 10 полях зрения), наличие очагов некроза, клеточная атипия. Однако эти показатели не являются достаточно специфичными [30]. Поэтому морфологические критерии не всегда эффективны при дифференциальной диагностике ДМЛ с лейомиосаркомой. Некроз и клеточная атипия нередко наблюдаются в доброкачественных опухолях, а подсчет фигур митоза требует тщательной вырезки материала и высокого качества препаратов. Кроме того, возникают сложности в оценке характера процесса при «пограничном» числе митозов (4—5 в 10 полях зрения). Оценка пролиферативной активности опухоли (индекс Ki-67) может служить лишь вспомогательным методом. Более точным способом, позволяющим достоверно дифференцировать лейомиому и лейомиосаркому, является молекулярно-генетическое исследование.
В отделении патологической анатомии МНИОИ им. П.А. Герцена разработана молекулярно-генетическая тест-система для дифференциальной диагностики пролиферирующей клеточной лейомиомы и лейомиосаркомы матки, которая использовалась в качестве дополнительного метода [40]. Тест-система состоит из 6 высокополиморфных микросателлитных маркеров: D10S1146, D10S1213, D10S218, D10S24, D9S942, D3S1295, расположенных в хромосомных районах 10q22.1, 10q26.13, 10q22.1, 10p13, 9p21.3, 3p14.3 соответственно. Специфичность и чувствительность разработанной тест-системы составляет 96 и 95% соответственно.
Для генетического исследования используют образцы опухолевой и нормальной тканей пациента. На гистологическом препарате опухолевые клетки должны составлять более 70% всех клеток. При отсутствии гистологического препарата нормальной ткани используют образец периферической венозной крови пациента. ДНК для анализа выделяют из материала, фиксированного в формалине с последующей парафинизацией, с помощью коммерческого набора ДНК-Сорб (В/АМ) («ИнтерЛабСервис», Россия) и/или набора QIAamp DNA FFPE Tissue kit («QIAGEN», Германия) в соответствии с инструкциями производителя. Идентификацию потери гетерозиготности и/или микросателлитной нестабильности проводят путем микросателлитного анализа, представляющего собой полимеразную цепную реакцию с соответствующими праймерами.
Потерю гетерозиготности оценивают как ослабление или отсутствие полосы одного из аллелей на электрофореграмме относительно нормальной ткани/периферической венозной крови пациента. Микросателлитная нестабильность устанавливается как появление дополнительной полосы на электрофореграмме относительно нормальной ткани/периферической венозной крови пациента.
Описанная методика позволяет значительно повысить точность диагностики высокодифференцированной лейомиосаркомы матки. Однако до настоящего времени мы применяли данный метод в сомнительных случаях, при наличии клеточной лейомиомы с «пограничным» числом митозов (4—5 в 10 полях зрения). Особый интерес представляло исследование метастазирующей лейомиомы без морфологических признаков малигнизации.
Приводим наше наблюдение.
Пациентка 54 лет, поступила в МНИОИ им. П.А. Герцена 30 января 2012 г. с диагнозом: лейомиома тела матки, двусторонняя цистаденома яичников. При клиническом обследовании патологических очагов в других органах, в том числе легких, не обнаружено. В анамнезе — диагностическое выскабливание полости матки по поводу простой гиперплазии эндометрия 2 года назад. Выполнено хирургическое лечение в объеме лапароскопической экстирпации матки, двусторонней аднексэктомии с удалением уплотненного увеличенного лимфатического узла тазовой клетчатки.
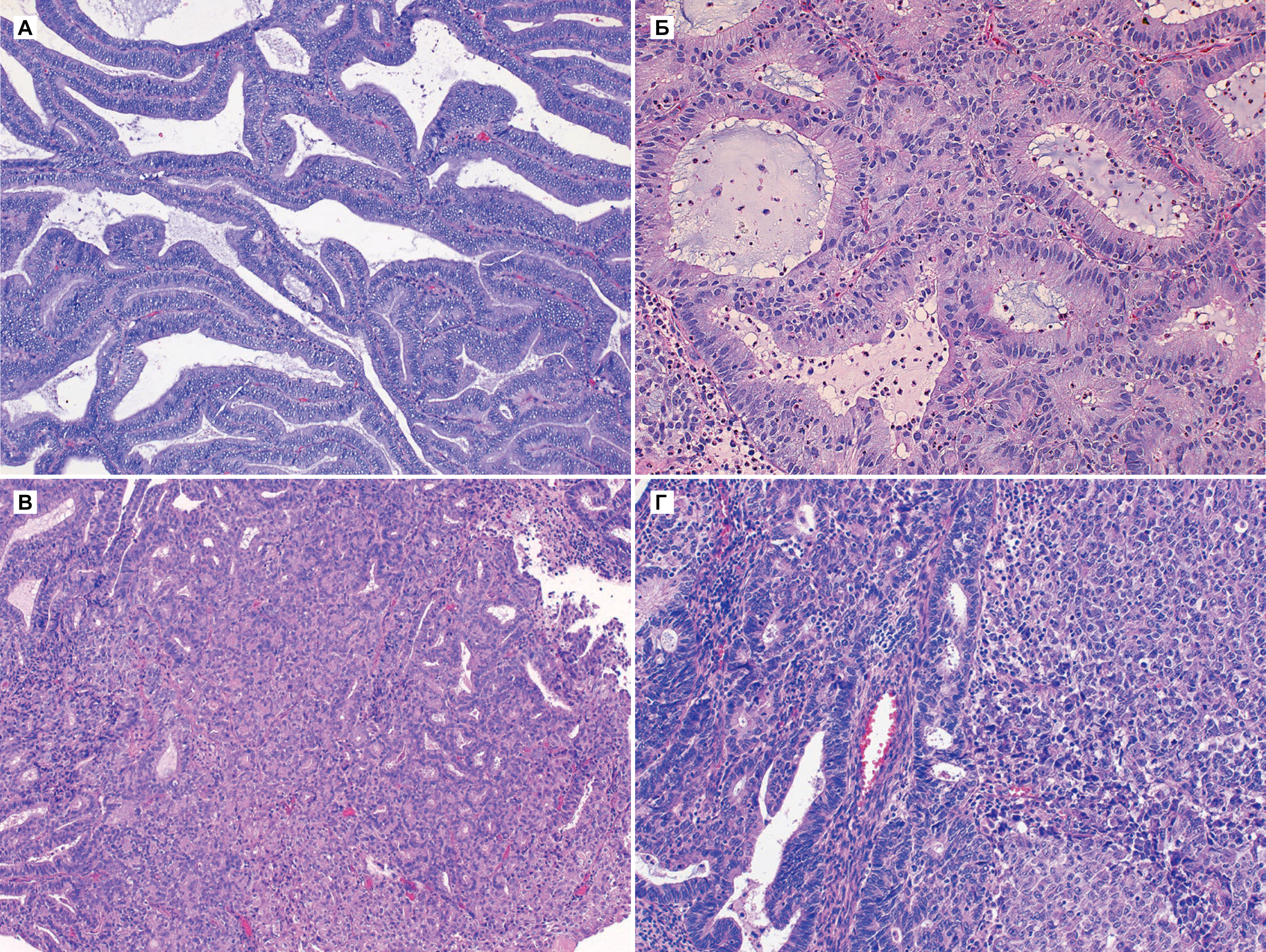
При макроскопическом исследовании операционного материала матка увеличена до 27×26×20 см, полость матки щелевидная, деформирована извне, эндометрий сероватого цвета. Миометрий серо-розовый с субсерозным узлом, диаметром 25 см. На разрезе — опухоль белесовато-розового цвета, волокнистого вида с крупными очагами некроза, миксоматоза, кровоизлияний. В миометрии имеются другие опухолевые узлы размером 1—15 см, один из которых с полостью диаметром 10 см. Узлы белесоватого цвета, волокнистого вида. Лимфатический узел диаметром 1,5 см, плотный.
Гистологическое исследование: в матке — множественные узлы пролиферирующей лейомиомы, некоторые с обширными участками некроза, до 4—5 митозов в 10 полях зрения (см. рисунок, г, д). 
По данным молекулярно-генетического исследования материала парафиновых блоков опухоли, смежной нормальной ткани яичника и метастаза в лимфатическом узле, в локусах D3S1295, D9S942, D10S1213, D10S1146, D10S24, D10S218 потери гетерозиготности и микросателлитной нестабильности, характерных для лейомиосаркомы матки, не обнаружено (см. рисунок, е).
Таким образом, с учетом данных морфологического и молекулярно-генетического исследований диагностирована метастазирующая лейомиома (код ICD.0-8898/1).
ДМЛ — редкая опухоль с неясным патогенезом. Несмотря на доброкачественные гистологические характеристики, ДМЛ имеет потенциальный риск рецидивирования и малигнизации. В настоящее время наиболее достоверным методом, позволяющим провести дифференциальную диагностику между ДМЛ и лейомиосаркомой матки, является генетическое исследование потери гетерозиготности и микросателлитной нестабильности в опухоли.
В приведенном клиническом наблюдении молекулярно-генетическое исследование проводилось не только на опухолевом материале и морфологически неизмененной ткани яичника, но и на материале, полученном из метастаза в лимфатическом узле, для определения единого происхождения опухоли в матке и лимфатическом узле и выявления доброкачественной или злокачественной природы этих новообразований.
Несмотря на то что термин ДМЛ широко принят в мировой литературе, ни данные опухоли, ни метастазы не имели морфологических или генетических признаков злокачественности, поэтому мы считаем, что термин «системный лейомиоматоз» лучше отражает суть процесса.