Мобилизация это что в медицине
Инструментальная мобилизация мягких тканей (ИММТ)
Аббривиатуры IASTM или ИММТ обозначают довольно молодой метод инструментальной мобилизации мягких тканей. Наряду с массажами, мануальной терапией и другими техниками его применяют для лечения хронических и острых повреждений.
Современная медицина описала и стала использовать этот метод сравнительно недавно. Основоположником ИММТ считается Дэвид Грэстон, который заговорил о таком способе лечения в 90-е годы прошлого века. В то же время он представил и первые инструменты, разработанные им для проведения терапии такого рода.
Представляя новую методику, он указал, что в ее основу легли древние восточные знания. А точнее, китайская терапия “гуа ша”. С ее помощью лечили людей более чем за 200 лет до нашей эры.
Похожие методики использовали и в других культурах. Инструменты, похожие на те, что использовали китайские целители, были обнаружены среди артефактов, оставшихся от Древнего Рима и Античной Эллады. Это небольшие скребки, формой напоминающие вопросительные знаки. Делали их из металла и, насколько можно судить по дошедшим до нас документам, использовали в основном в термах.
Конечно, современная методика ИММТ представляет собой гораздо более сложный процесс. В ее рамках используются техника Грэстона, техника фасциальной шлифовки, проводится мобилизация мягких тканей при помощи звука. Для проведения всех манипуляций существует большое количество специальных инструментов разных форм. Каждый изготовлен из наиболее подходящего материала, имеет свое название и узкое предназначение.
IASTM-терапия старой и новой школы
За несколько десятков лет существования направления между сторонниками терапии наметился раскол. Специалисты разделились на два лагеря: старую и новую школы. Последователи инновационного подхода считают, что классическая терапия хоть и дала прочную базу, все же имеет, как минимум, три существенных недостатка.
За время существования IASTM-терапии в таком виде эффективность, безусловно, наблюдалась. Мануальные вмешательства оборачивались видимыми результатами. Многие специалисты давали свои объяснения этому, однако в подавляющем большинстве они были сосредоточены лишь на механических изменениях. В частности, отмечалось:
Сторонники новой школы предлагают более широкое осмысление метода. Они предлагают принять за основу тот факт, что ИММТ эффективна и при воздействии на скелетную, миофасциальную и нервную системы движения.
Таким образом, главное, что отличает специалистов-новаторов заключается в том, что главным механизмом воздействия является НЕЙРОФИЗИОЛОГИЧЕСКИЙ. Именно благодаря ему методика действенна, эффективна и дает ясно различимые результаты.
Причем здесь сенсорные рецепторы?
Тот факт, что движение человека обеспечивает костно-мышечная система, знают даже люди, не имеющие медицинского образования. Однако специалисты могут добавить, что ни одна мышца не дрогнет без воздействия сенсорных рецепторов.
При их отсутствии мы не могли бы сделать и шага, будь даже наши кости крепчайшими, а мышцы максимально эластичными. Но только сигнал в мозг может заставить их прийти в движение. Это крайне важный момент для понимания методики IASTM.
Все сенсорные рецепторы, которые задействованы в двигательном процессе, делятся на три группы:
Большое значение для совершения тех или иных движений имеет фасциальная система. В ней находится в 10 раз больше рецепторов, чем в мышцах. Известно, что фасциальная система содержит механорецепторы четырех основных видов. Они проявляют чувствительность к механическим деформациям и оказывают важнейшее влияние на деятельность опорно-двигательной системы организма. Перечислим основные функции каждого вида механорецепторов.
Сухожильный орган Гольджи
Участвует в процессе регулирования мышечного напряжения. Именно благодаря ему удается избегать травм. Во время сеансов мануальной терапии сухожильный орган Гольджи также способен контролировать тонус мягких тканей. Он получает толчок для начала работы, когда активируются мышцы. Его роль в неврологическом тонусе мягких тканей достаточно высока, недооценивать ее — грубейшая ошибка.
Тельца Пачини
В зоне их ответственности лежит распознавание степени давления. Другая важная роль, которую они выполняют — детектор вибрации (или коротких, быстрых стимулов). При хронических болях стимулирование телец Пачини может оказаться действенным способом лечения. Эти рецепторы способны бороться с таким проявлением постоянных болей как своеобразный “эффект смазанности”. Его механизм заключается в том, чтобы “отключить” в головном мозге тот участок, который отвечает за восприятие страдающей части тела. Отключение может быть полным, при котором человек перестает чувствовать, что происходит с больным участком. А может — частичным, когда ощущения становятся не такими четкими как в обычном состоянии. Иначе говоря, смазанными. Интересно, что сама боль при этом никуда не исчезает. Чревато данное состояние тем, что организм не может дать адекватную реакцию на все, что происходит с пораженным участком. Воздействуя на тельца Пачини, специалист восстанавливает контроль за телом.
Тельца Руффини
Ответственны за восприятие медленного или пассивного воздействия на тело. Реагируют на растяжение кожи, тепло. Не нуждаются в давлении во время мануальных процедур для снижения тонуса мягких тканей.
Рецепторы интерстициальных волокон (их также определяют как свободные нервные окончания)
В большом количестве присутствуют в фасции, в мышцах содержание интерстициальных волокон на порядок ниже. Их функция заключается в реагировании на аккуратные легкие касания. Также отвечают за снятие болезненных ощущений.
Результаты мануальной терапии зависят от изменений в мягких тканях, происходящих на нейросенсорном уровне ничуть не меньше, чем от изменений на уровне механическом. Когда специалисты при помощи своих инструментов оказывают определенное влияние на ткань, в головной мозг поступает соответствующая информация. И то, какое действие она произведет, во многом предопределяет результат, который выдает опрно-двигательная система.
Получается, мы вынуждаем именно нервную систему заниматься регулированием тонуса мягких тканей, подталкивая ее действовать в нужном нам направлении. Это вполне оправданно можно определять как неврологическую “настройку” мозга, при помощи которой можно исправлять возникшие проблемы с мобильностью. Так, стимулируя тельца Руффини после тренировки, мы тем самым снимаем гипертонус, который может возникнуть в этот момент. Или воздействуя на тельца Пачини перед тренировкой, мы готовим мышцы к предстоящей работе (кстати. делать это рекомендуем при помощи быстрых осцилляций).
ИММТ является частью двигательной концепции RockTape. Пожалуй, на сегодняшний день это лучшая иерархия, которая помогает действительно эффективно воздействовать на движения человека, постепенно устраняя все патологии, мешающие осуществлять нормальную жизнедеятельность.
Да, эта пирамида состоит из нескольких ступеней. На каждой отмечается свой маленький результат. Их совокупность и дает тот самый максимальный эффект, который обеспечивает значительные улучшения состояния больного.
Важно то, что новая школа ИММТ дает возможность закрепить тот прогресс, которого удается достичь за время манипуляций. Это происходит благодаря кинезеологическому тейпированию, которое поддерживает современная инструментальная терапия.
В чем заключаются преимущества инструментов RockBlades?
Чем больше разных техник используется в работе специалистов, тем более полной и результативной будет его работа. Раньше проблема заключалась в том, что для множества манипуляций требовались отдельные инструменты. Их приобретение было делом непростым и затратным.
Однако RockBlades сделала инструменты универсальным и доступным орудием врача. Сегодня есть возможность приобрести несколько вариантов наборов:
Преимущества инструментов RockBlades хорошо видны на видео. Благодаря ему можно оценить, насколько точно выверена конфигурация каждого. Именно эта тщательность и доскональность сделала возможной проводить ими мобилизацию тканей на любом участке тела.
С помощью этих инструментов врачу гораздо проще определить свойства пораженных тканей. В местах, где имеется патология сопротивление повышается, и прибор в руке специалиста передает это ощущение.
Когда мобилизация мягких тканей становится необходимостью?
Для проведения IASTM-терапии имеются свои показания и противопоказания.
ПОКАЗАНИЯ для ИММТ/IASTM терапии
ПРОТИВОПОКАЗАНИЯ для ИММТ/IASTM терапии
Наши специалисты
Мизонов Сергей Владимирович
Мобилизация это что в медицине
Неврологическое отделение Республиканской клинической больницы им. Г.Г. Куватова
Башкирский государственный медицинский университет, Уфа
Ранняя мобилизация после инсульта
Журнал: Вопросы курортологии, физиотерапии и лечебной физической культуры. 2015;92(1): 46-50
Кутлубаев М. А., Ахмадеева Л. Р. Ранняя мобилизация после инсульта. Вопросы курортологии, физиотерапии и лечебной физической культуры. 2015;92(1):46-50.
Kutlubaev M A, Akhmadeeva L R. The early post-stroke mobilization. Voprosy kurortologii, fizioterapii, i lechebnoi fizicheskoi kultury. 2015;92(1):46-50.
https://doi.org/10.17116/kurort2015146-50
Неврологическое отделение Республиканской клинической больницы им. Г.Г. Куватова
Ранняя мобилизация является важным условием для успешного восстановления после инсульта. Однако в настоящее время неясно, как рано можно начинать мобилизацию. Три рандомизированных контролируемых исследования (РКИ) были посвящены сравнению эффективности и безопасности очень ранней (в течение 1-х суток после инсульта) и ранней (в течение 2-х суток после инсульта) мобилизации. Метаанализ результатов этих исследований не выявил каких-либо преимуществ очень ранней перед ранней мобилизацией. В одном РКИ было проведено сравнение мобилизации на 3-и и 7-е сутки после инсульта и было показано, что более ранняя мобилизация связана с меньшим количеством осложнений и не имеет отрицательного влияния на церебральную гемодинамику. Рядом наблюдательных исследований подтвердили положительный эффект ранней мобилизации на исходы инсульта. Таким образом, при отсутствии противопоказаний оправданным будет начало мобилизации на 2-е сутки после инсульта, в то время как целесообразность очень ранней мобилизации неясна.
Неврологическое отделение Республиканской клинической больницы им. Г.Г. Куватова
Башкирский государственный медицинский университет, Уфа
Церебральный инсульт является 3-й по частоте причиной смерти и 1-й по частоте причиной инвалидизации в развитых странах [1]. В связи с этим своевременная реабилитация пациентов, перенесших инсульт, является одной из наиболее актуальных проблем современной восстановительной медицины. Лечение и реабилитация пациентов после инсульта проводится в специализированных отделениях (stroke unit). Было достоверно показано, что лечение в специализированном отделении значительно снижает смертность после инсульта и степень инвалидизации. Одним из основных принципов работы специализированных инсультных отделений является ранняя мобилизация и начало реабилитационных мероприятий [1]. При сравнении исходов среди пациентов, которые проходили лечение в специализированном инсультном отделении и в обычном терапевтическом отделении, было показано, что более ранняя мобилизация в специализированном отделении является основным фактором, снижающим длительность пребывания пациента в стационаре [2—5]. Это связано с тем, что восстановление неврологического дефицита после инсульта наиболее активно происходит в течение первых месяцев и достигает плато примерно через 3 мес [6]. В связи с этим ранняя мобилизация * и начало занятий лечебной физической культурой (ЛФК) являются принципиально важными аспектами в работе с пациентами после инсульта. Однако в настоящее время неясно, когда именно после инсульта следует начинать мобилизацию. Разные ответы на этот вопрос дают различные руководства: рекомендуется проводить мобилизацию «в первый день после инсульта», «рано», «как только состояние пациента стабилизируется» [7—10].
Ранняя мобилизация, с одной стороны, может ускорить восстановление после инсульта [11] и предупредить целый ряд таких осложнений, как пневмония, тромбоз глубоких вен голени, образование пролежней [12] и депрессия [14]. С другой стороны, у многих пациентов в остром периоде инсульта нарушается ауторегуляция церебральной гемодинамики и ранняя вертикализация может привести к снижению системного артериального давления и гипоперфузии головного мозга, включая область ишемической полутени — пенумбры, и к последующему увеличению очага ишемии [15, 16]. A. Wojner и соавт. [17] провели исследование 11 пациентов с острым инсультом и выявили зависимость скорости кровотока в средней мозговой артерии (СМА) по данным транскраниальной допплерографии от положения головы. Снижение уровня головы с 30° до нуля привело к повышению скорости кровотока в СМА на 13%. V. Novak и соавт. [18] продемонстрировали снижение скорости кровотока в СМА на стороне нарушения мозгового кровообращения у пациентов через 2 мес после малого инсульта при проведении ортостатической пробы. Изменения гемодинамики были более значимыми у пациентов, не страдавших артериальной гипертензией. Ассиметричное снижение кровотока в СМА было связано со снижением системного АД. В тоже время В. Panayiotou и соавт. [19] показали, что при вертикализации в течение первых двух суток после среднетяжелого инсульта у пациентов не развивается ортостатическая гипотензия. Более того, у пациентов с острым инсультом в отличие от группы контроля, которую составили пациенты терапевтического профиля, отмечалось повышение среднего АД при вертикализации, что объясняется гиперактивностью симпатической нервной системы.
Даже при отсутствии четких руководств идея очень ранней (в первые сутки после инсульта) мобилизации популярна среди специалистов. Опрос, проведенный в Австралии, в котором приняли участие 202 человека (врачи, инструкторы ЛФК, логопеды, медсестры), показал, что 40% специалистов поддерживали концепцию очень ранней реабилитации [20]. Анализ деятельности инструкторов ЛФК в Нидерландах (опрошен 91 человек) показал, что 76% специалистов приступают к мобилизации в течение первых суток после инсульта [21]. Однако, несмотря на противоречивые результаты небольших экспериментальных работ, с одной стороны, и мнения экспертов — с другой, наибольшего внимания заслуживают данные рандомизированных испытаний, посвященных эффектам ранней и очень ранней мобилизации на исходы инсульта.
Очень ранняя мобилизация исследовалась в трех рандомизированных контролируемых исследованиях (РКИ). P. Langhorne и соавт. [22] провели пилотное исследование VERITAS (Very Early Rehabilitation or Intensive Telemetry after Stroke — очень ранняя реабилитация или интенсивная телеметрия после инсульта). 32 пациента были рандомизированы в 4 группы: 1-я — стандартное лечение; 2-я — ранняя мобилизация; 3-я — автоматизированный мониторинг для выявления осложнений, таких как гипоксия; 4-я — ранняя мобилизация и автоматизированный мониторинг. Результаты исследования показали, что сверхранняя мобилизация повышает вероятность того, что пациент сможет ходить на 5-е сутки, а также снижает риск развития осложнений иммобилизации [22].
A. Sundseth и соавт. [23] провели рандомизированное исследование, в котором сравнивали эффекты мобилизации пациентов в 1-е сутки (27 человек) и на 2-е сутки (29 человек) после инсульта. В группе мобилизации в 1-е сутки после инсульта через 3 мес отмечались худшие исходы (выше летальность и степень инвалидизации), в то же время у пациентов, которые были мобилизированы в течение 2-х суток после инсульта, отмечался меньший неврологический дефицит, однако эти различия не достигли статистической значимости. Авторы подчеркивают, что небольшое число пациентов в исследовании не позволяет делать однозначных выводов по полученным результатам [23]. Анализ факторов, которые могли бы объяснить лучшие исходы в когорте пациентов, не выявил какой-либо конкретный фактор [24].
Самое крупное исследование, проведенное на сегодняшний день по проблеме очень ранней мобилизации после инсульта — AVERT II (A Very Early Rehabilitation Trial, исследование очень ранней реабилитации) [25, 26]. Это РКИ II фазы, проведенное в Австралии, направленное на выяснение безопасности и осуществимости мобилизации в течение 1-х суток после инсульта. Был рандомизирован 71 человек (33 — стандартный уход, 38 — ранняя мобилизация) преимущественно с ишемическим инсультом. Критериями исключения (и соответственно противопоказаниями для ранней и очень ранней мобилизации) были: ухудшение состояния в первые часы после поступления, прогрессирование неврологического дефицита, острый коронарный синдром, выраженная сердечная недостаточность, терминальное состояние, систолическое АД 220 мм. рт.ст., температура тела >38,5 °С, сатурация кислорода крови менее 92%, пульс 100 ударов в минуту. Анализ исходов (смертность, неврологический дефицит, развитие осложнений), проведенный через 3 мес после инсульта, показал отсутствие статистически значимых различий в двух группах. В то же время авторам удалось достичь основной цели — показать безопасность и осуществимость сверхранней мобилизации, чтобы обосновать более крупное исследование со схожим дизайном. Дополнительный анализ данных, полученных в AVERT II, показал, что сверхранняя мобилизация, вероятно, является экономически эффективным вмешательством [27] и ускоряет начало ходьбы после инсульта [28].
L. Craig и соавт. [29] провели метаанализ данных отдельных пациентов из двух вышеупомянутых исследований — AVERT и VERITAS. После объединения данных в группе сверхранней мобилизации оказалось 54 человека, в группе стандартного ухода — 49. Вероятность функциональной независимости пациентов в группе сверхранней мобилизации была значительно выше, чем в группе стандартного ухода: отношение шансов 3,11; 95% доверительный интервал 1,03—9,33. Однако классический метаанализ результатов всех трех исследований, проведенный E. Lynch и соавт. [30], выявил тенденцию к меньшей смертности (p=0,06) в группе стандартного ухода, другие исходы (степень инвалидизации, количество осложнений) не различались в двух группах.
Более достоверные данные ожидаются после завершения третьей фазы РКИ AVERT. На сентябрь 2014 г. в исследование были включены более 2 тыс. человек (более 98% от запланированного числа участников). Завершение исследования планируется в 2015 г. [31].
K. Diserens и соавт. [12] сравнили эффекты ранней (в среднем после 52 ч) и поздней (более чем через 7 дней) мобилизации после инсульта в РКИ. Проанализировав данные 50 пациентов, авторы показали, что при ранней мобилизации снижается число тяжелых осложнений, в то время как общее число осложнений, а также выраженность неврологического дефицита через 3 мес не различались в обеих группах. Также с помощью транскраниальной допплерографии было показано, что ранняя мобилизация не приводит к нарушению церебральной гемодинамики.
В нескольких наблюдательных исследованиях был проведен ретроспективный анализ связи между временем, прошедшим от момента развития инсульта до начала мобилизации, и функциональными исходами. Было показано, что чем раньше начата мобилизация, тем выше балл по шкале Бартела (т.е. лучше исход). В двух исследованиях авторы сравнивали раннюю мобилизацию в первые 3 сут после инсульта и позднюю, на 4-е сутки и позже. У пациентов из группы ранней мобилизации отмечалась меньшая степень инвалидизации, а также выше степень подвижности и активности в повседневной жизни, в то же время уровень смертности не различался в обеих группах [32—39]. Особого подхода требует ранняя реабилитация пациентов с тяжелой сопутствующей патологией, в частности с хронической сердечной недостаточностью [40].
Вопрос о начале мобилизации после ишемического инсульта и проведенного тромболизиса решается индивидуально. J. Ha и соавт. [41] провели исследование факторов, которые влияют на решения вопроса о мобилизации в данной группе пациентов. Авторы опросили 45 старших врачей и медсестер инсультных отделений Австралии и выявили следующие факторы: усугубление неврологического дефицита, усугубление неврологического дефицита вследствие внутримозгового кровоизлияния, инфекционные осложнения, пневмония, тяжелый инсульт, сонливость, спутанность сознания. Основным фактором, связанным с ранней мобилизацией, вызывавшим беспокойство участников опроса, был риск падения пациентов [41].
Ранняя мобилизация при инсультах без выраженного неврологического дефицита не представляет больших трудностей, в то время как при тяжелых инсультах нередко приходится прибегать к помощи технических средств, таких как вертикализатор. M. Baltz и соавт. [42] провели пилотное исследование, в котором показали, что 19 из 36 пациентов в остром периоде инсульта нормально перенесли вертикализацию на ортостатическом столе на 60° или более продолжительностью минимум 5 мин. Основной причиной прекращения вертикализации у оставшихся пациентов было чрезмерное снижение диастолического АД.
Все приведенные выше данные касались всех типов инсультов за исключением субарахноидального кровоизлияния (САК), частота которого составляет 5% от всех инсультов. САК чаще поражает тех, кому меньше 60 лет и в 85% случаев связано с разрывом церебральной аневризмы [43, 44]. Одним из тяжелейших осложнений САК считается повторное кровоизлияние, которое чаще всего развивается в течение первых 4—6 нед после первого кровоизлияния и является причиной смерти примерно половины пациентов, умерших от данного заболевания. Основной метод предотвращения повторного кровоизлияния — оперативное лечение аневризмы [43, 44]. Однако оно возможно не во всех случаях, и тогда возникает вопрос об оптимальном времени мобилизации. По современным рекомендациям, пациент после САК, если ему не была проведена эмболизация или клипирование аневризмы, должен придерживаться постельного режима 4—6 недель. Z. Ma и соавт. [45], учитывая тенденции к ранней реабилитации при других типах инсультов, а также данные S. Juvela [46], указывающие на то, что повторные кровоизлияния чаще случаются в первые сутки после САК, попытались провести Кохрановский обзор по данной проблеме. Однако авторам не удалось найти каких-либо РКИ, посвященных ранней мобилизации после САК. В связи с этим в настоящее время сохраняют свою актуальность рекомендации соблюдать охранительный режим в течение 4—6 нед после САК.
Таким образом, в настоящее время вопрос, когда начинать мобилизацию и ЛФК после инсульта, остается открытым. При отсутствии противопоказаний оправданным будет начало мобилизации на 2-е сутки после инсульта. В то же время целесообразность более ранней мобилизации, по имеющимся на сегодняшний день данным, сомнительна. Однако результаты проходящего в настоящее время РКИ AVERT III могут изменить наши взгляды на данную проблему.
Конфликт интересов отсутствует.
Концепция статьи, сбор и обработка материала, написание текста: М.К.
Концепция статьи, редактирование: Л.А.
* Под мобилизацией, как правило, понимают любые формы физической активности, включая пассивные движения, однако, по мнению ряда специалистов, мобилизацией следует считать перемещение пациента за пределы кровати [12, 13].
Мобилизация это что в медицине
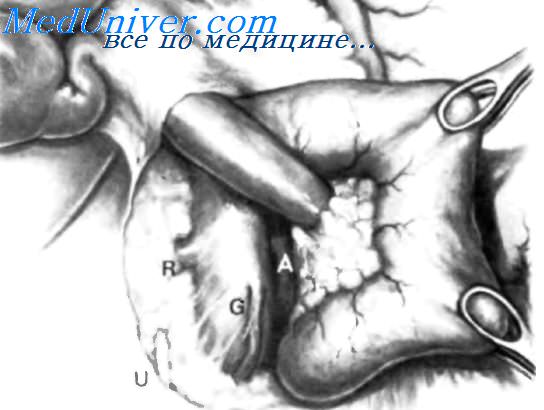
После тщательной ревизии брюшной полости с целью поиска метастатических поражений внимание направляют на гепатобилиарную и дуоденальную зоны. Для этого производят мобилизацию по Vautrin-Kocher. Ее выполняют в два этапа. На первом этапе отводят вниз поперечную ободочную кишку и ее брыжейку, как показано на рисунке. При этом нисходящая часть двенадцатиперстной кишки и латеральная сторона нижней горизонтальной части становятся доступными обзору. Низведение выполняют острым путем с помощью ножниц.
Поперечную ободочную кишку с ее брыжейкой оборачивают салфеткой и оттесняют вниз. Затем выполняют второй этап мобилизации по Vautrin-Kocher. Рассекают брюшину по всей длине латерального края нисходящей части двенадцатиперстной кишки до латерального сегмента нижней горизонтальной части двенадцатиперстной кишки, включая его и передний листок печеночно-двенадцатиперстной связки.
Латеральный край нисходящей части двенадцатиперстной кишки отводят вверх и влево. Это может сделать первый ассистент рукой или атравматическим зажимом типа Foerster или Babcock. Такой прием дает возможность хирургу легко мобилизовать двенадцатиперстную кишку и головку поджелудочной железы в практически бескровной зоне фасции Treitz. Правильно проведенная мобилизация по Vautrin-Kocher позволит увидеть нижний сегмент общего желчного протока, верхнезаднюю часть головки поджелудочной железы, нижнюю полую вену, участок правой почечной вены (R), внутреннюю часть почечной жировой капсулы вместе с почкой и правым мочеточником (U), правую гонадную вену (G), аорту (А) и начало верхней брыжеечной артерии. Мобилизация по Vautrin-Kocher облегчит последующие хирургические манипуляции и позволит выявить прорастание опухоли в позадилежащие ткани и нижнюю полую вену. При прорастании в нижнюю полую вену опухоль следует считать неоперабельной.
Завершив мобилизацию по Vautrin-Kocher, рассекают желудочно-ободочную связку под сосудистой желудочно-сальниковой дугой.
Хирургическая ревизия поджелудочной железы.
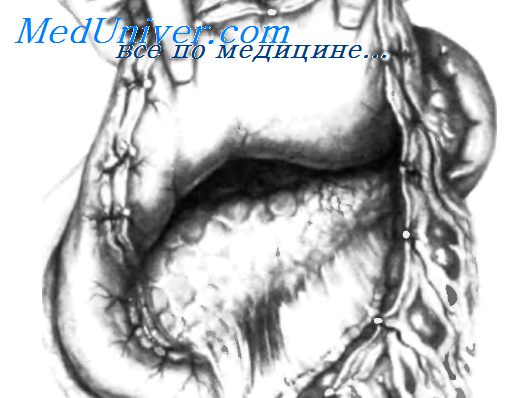
После рассечения желудочно-сальниковои связки желудок оттягивают вверх, а поперечную ободочную кишку с ее брыжейкой — вниз, обнажая всю переднюю поверхность поджелудочной железы, как видно на рисунке.
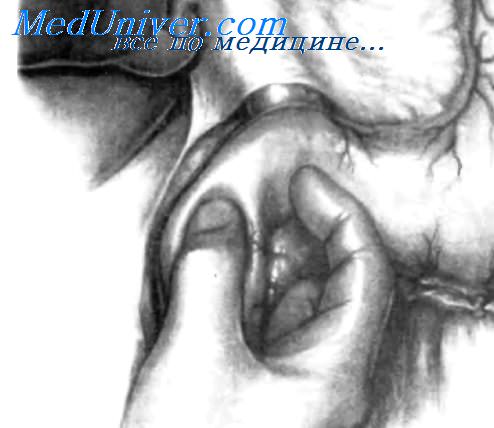
Этот прием позволяет адекватно обследовать головку поджелудочной железы спереди и сзади, а также переднюю поверхность ее тела и хвоста. Для пальпации головки поджелудочной железы левый большой палец накладывают спереди, а указательный и средний пальцы левой руки — сзади, как изображено на рисунке. Этот прием позволяет установить наличие опухоли в головке поджелудочной железы, а также ее размер, форму, консистенцию, мягкость и границы. Если проток поджелудочной железы значительно расширен, его также можно почувствовать, проводя большой палец влево от опухоли, выявляя различие между плотной неравномерной массой и эластично-упругим по консистенции панкреатическим протоком. На вставке этот прием показан в полусхематическом разрезе.
Пальпация фатерова сосочка.
При пальпации фатерова сосочка может оказаться полезным прием, показанный на данном рисунке Правый большой палец хирурга прижимает противобрыжеечныи, или наружный, край двенадцатиперстной кишки к брыжеечному, или внутреннему, краю. Таким образом легко пальпируется экзофитно растущая опухоль фатерова сосочка. Небольшую мягкую опухоль или небольшую интрапапиллярную опухоль пропальпировать намного труднее. Некоторые другие приемы, необходимые для выявления этих опухолей, будут описаны в других статьях.
Выполняя эти предрезекционные приемы, необходимо попытаться нащупать крючковидныи отросток. При этом оказывается полезным следующий прием. Для его выполнения рассекают брюшину над внутреним краем поджелудочной железы на уровне перешейка. Затем хирург должен положить ладонь левой руки позади головки и перешейка поджелудочной железы и протолкнуть правый указательный палец под перешеек, пытаясь ощутить крючковидныи отросток, расположенный позади вехнебрыжеечных сосудов.