ora в офтальмологии что это такое
Значение исследования биомеханических свойств роговой оболочки в оценке офтальмотонуса
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Meaning of study of corneal biomechanical properties
in the evaluation of ophthalmotonus
E.A. Egorov, M.V. Vasina
Department of Ophthalmology of Medical Faculty
GOU VPO Russian State Medical University of Roszdrav
Ophthalmological Center “Doctor Visus”, Moscow
Измерение внутриглазного давления занимает важное место при обследовании пациента в практике врача–офтальмолога. Все практические методы тонометрии базируются на принципах применения силы к глазному яблоку и измерению образующейся деформации. Деформация может быть достигнута уплощением роговицы при аппланационной тонометрии или вдавлением глазного яблока при импрессионной тонометрии.
Альтернативный метод аппланационной тонометрии измеряет требуемую силу для уплощения определенной зоны роговицы, а не ее размер, как при использовании то-нометра Маклакова. Именно на этом принципе основан тонометр Г. Гольдмана (1954–1961 года), который до настоящего времени является «золотым стандартом» в измерении ВГД.
Анализатор биомеханических свойств глаза Ocular Response Analyzer (ORA, Reichert Inc., США) является бесконтактным тонометром, работающим по принципу динамической двунаправленной аппланации роговицы [1–7]. Измерения, произведенные на ORA, позволяют оценить:
– ВГД по Гольдману (ВГДг);
– ВГД роговично–компенсированное (ВГДрк);
– корнеальный гистерезис (КГ);
– фактор резистентности роговицы (ФРР);
– центральную толщину роговицы (ЦТР).
ВГД роговично–компенсированное расчитывается с помощью специального алгоритма на основании полученных данных клинических измерений.
Корнеальный гистерезис – разница между двумя регистрируемыми ORA значениями давления во время аппланации роговицы, возникающими в результате затухания воздушного импульса в вязко–эластичной роговичной ткани.
Фактор резистентности роговицы – дополнительный параметр, который рассчитывается с помощью специального алгоритма.
В этой работе мы ставили целью проанализировать результаты, полученные на данном аппарате.
Материалы и методы
Было обследовано 135 человек (240 глаз) в возрасте от 19 до 80 лет, из них 60 мужчин и 75 женщин. Все пациенты были разделены на три группы. Первая группа – условно здоровые, не имеющие в анамнезе повышения ВГД, не отягощенные наследственностью по глаукоме, с аномалиями рефракции не более 3,0D. Вторая – пациенты с кератоконусом различной степени. Третья группа – лица, страдающие ПОУГ с различной стадией глаукомного процесса.
Всем пациентам проводились визометрия, компьютерная периметрия, тонометрия, пахиметрия, гониоскопия, биомикроскопическое и офтальмоскопическое исследование, исследование на ORA (анализаторе биомеханических свойств роговицы).
Результаты
В группе здоровой популяции было обследовано 41 человек (79 глаз), из них 18 мужчин и 23 женщины в возрасте от 23 до 79 лет (46,8±17,81).
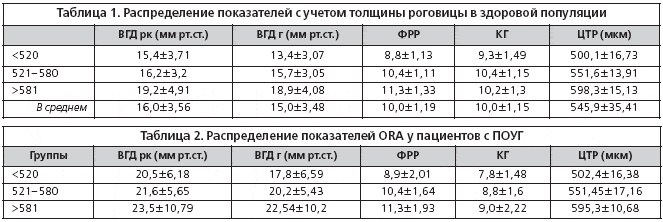
В группе здоровых пациентов мы выделили три подгруппы, различающиеся по толщине роговицы ( 581 мкм) и проанализировали все показатели, получаемые на анализаторе биомеханических свойств роговицы (рис. 1–3, табл. 1).
Во второй группе обследовано 17 пациентов (32 глаза) с кератоконусом, из них 10 мужчин и 7 женщин в возрасте от 19 до 45 лет (26,4±9,9).
Были получены следующие результаты:
ВГД рк=13,3±2,35
ВГД г=8,9±2,66
ФРР=6,1±1,31
КГ=7,7±1,41
ЦТР=445,2±14,21
В данной группе не только снижены все показатели, но и на корнеограмме два сигнала (пика) снижены по сравнению с группой здоровых пациентов. Исследование пациентов с кератоконусом показало: ФРР у них всегда значительно ниже, чем КГ (рис. 4).
В третью группу вошло 77 пациентов (129 глаз) с ПОУГ в возрасте от 42 до 80 лет (64,8±8,21).
Внутри данной группы были выделены три подгруппы, различающиеся по толщине роговицы: 1) 581мкм.
В группе с тонкой роговицей обследовано 27 пациентов (49 глаз) из них 12 мужчин и 15 женщин в возрасте от 43 до 77 лет (66,7±7,9). Распределение по стадиям глаукомы: I – 9 глаз (18%); II – 14 глаз (29%); III – 21 глаз (43%); IV – 5 глаз (10%).
Группу с ЦТР от 521 до 580 мкм составили 33 человека (52 глаза), возраст которых составлял 65,2±6,95 лет (от 52 до 76), из них 12 мужчин и 21 женщина. Соотношение по стадиям глаукомного процесса выглядело следующим образом: I – 23 глаза (44%); II – 11 глаз (21%); III – 16 глаз (31%); IV – 2 глаза (4%).
В группе с толстой роговицей (>581 мкм) обследовано 17 пациентов (28 глаз) – 8 мужчин и 9 женщин. Возраст в этой группе составлял в среднем 61,2±8,93 лет (от 42 до 80 лет). Стадии глаукомы распределились так: I – 13 глаз (46%); II – 8 глаз (29%); III – 6 глаз (21%); IV – 1 глаз (4%).
На рис. 5 приводится корнеограмма пациенки Г., 68 лет с диагнозом OS о/у IIа глаукома. ВГД рк=16,3 ВГД г=11,0 ФРР=5,8 КГ=6,6 ЦТР=478.
Данные, полученные на ORA, у пациента Г., 61 года с диагнозом OD о/у IIIа глаукома, представлены на рис. 6. ВГД рк=13,3 ВГД г=11,5 ФРР=8,6 КГ=8,6 ЦТР=610.
КГ снижается при повышении ВГД как по Гольдману, так и по роговично–компенсированному, а при снижении офтальмотонуса происходит повышение КГ.
На рис. 7 и 8 приводятся кератограммы пациента Г., 67 лет с диагнозом OS о/у II глаукома с повышенным офтальмотонусом и после его снижения на фоне приема гипотензивной терапии.
При наличии ПОУГ на одном глазу показатели КГ ниже показателей КГ на другом глазу без глаукомы у одного и того же пациента.
В глазах после антиглаукоматозных операций КГ выше, чем на другом, не оперированном глазу при гипотензивной медикаментозной терапии. Полученные результаты требуют дополнительного анализа, что может служить косвенным признаком степени компенсации ВГД.
Выводы
1. Значения КГ повышаются с увеличением ЦТР как в группе здоровых пациентов, так и в группе глаукомных пациентов.
2. При повышении ВГД происходит снижение КГ, при снижении офтальмотонуса КГ повышается, то есть имеется обратно пропорциональная зависимость.
3. ФРР ниже показателей КГ у пациентов с кератоконусом, что может быть прогностическим признаком при заболеваниях роговицы.
4. У глаукомных больных КГ, как правило, ниже ФРР.
5. Низкий КГ не может считаться предрасполагающим фактором в возникновении глаукомы, так как связан с толщиной роговицы, показатели которой должны соизмеряться с ВГД.
6. Исследование на ORA требует определенных навыков и знаний в правильной трактовке получаемых результатов.
Литература
1. Астахов Ю.С., Акопов Е.Л., Потемкин В.В. Влияние толщины и биомеханических свойств роговой оболочки на современные методы измерения внутриглазного давления // Материалы VI Всероссийской школы офтальмологов. – М., 2007. – С. 28 – 39.
2. Еричев В.П., Еремина М.В., Якубова Л.В., Арефьева Ю.А. Анализатор биомеханических свойств глаза в оценке вязко–эластических свойств роговицы в здоровых глазах // Глаукома. – 2007. – № 1. – С. 11 – 15.
3. Любимов Г.А. История развития и биомеханическое содержание измерения внутриглазного давления по методу Маклакова // Глаукома. – 2006. – № 1. С. – 43 – 51.
4. Stodtmeister R. Applanation tonometry and correction according to corneal thickness // Acta Ophthalmol Scand 1998. – 76: 319–24.
5. Whitacre M. M., Stein R. A., Hassanein K. The effect of corneal thickness on applanation tonometry // Am J Ophthalmol 1993; 115: 592–6.
6. Doughty M. J., Zaman M. L. Human corneal thickness and its impact on intraocular pressure measures: a review: a meta–analysis approach // Surv Ophthalmol 2000; 44: 367–408.
7. Felipe A. Medeiros, MD and Robert N. Weinreb, MD Evaluation of the Influence of Corneal Biomechanical Properties on Intraocular Pressure Measurements Using the Ocular Response Analyzer // Glaucoma 2006;15:364–370.
Глаукома
Глаукома — это хроническое заболевание глаза, при котором повышается внутриглазное давление (ВГД) и поражается зрительный нерв. При этом зрение снижается, вплоть до наступления слепоты. Слепота, порожденная глаукомой, носит необратимый характер, так как погибает зрительный нерв. Вернуть зрение ослепшему в этом случае больному уже невозможно!
При своевременном обнаружении и правильном лечении, благодаря современным методам, большинству больных глаукомой удается сохранить зрение.
К сожалению, глаукома — довольно распространенное заболевание. Им страдают преимущественно люди в возрасте старше 40 лет. Но этот недуг может поразить и молодых людей (юношеская глаукома) и даже новорожденных (врожденная глаукома).
Сегодня офтальмологии известен только один путь предупреждения слепоты при глаукоме: своевременное распознавание и правильное лечение.
Причины возникновения глаукомы
Равновесие между количеством вырабатывающейся в глазу жидкостью и жидкостью, оттекающей из глаза, обеспечивает постоянство внутриглазного давления. Нормальные цифры внутриглазного давления индивидуальны, но в среднем они колеблются в пределах 16–25 мм ртутного столба.
Повышение глазного давления приводит к сдавливанию нервных волокон. Сосуды, питающие зрительный нерв, перегибаются, и его кровоснабжение существенно нарушается. Если зрительный нерв находится в таком состоянии все время, он атрофируется, и зрение ухудшается.
Для глаукомы характерны три основных признака :
Повышение внутриглазного давления
Сужение поля зрения
Развитие атрофии (гибели) зрительного нерва


Диагностика и лечение глаукомы
Оказание высококвалифицированной помощи при глаукоме — весьма актуальная задача. Потребность в этой помощи в Нижне–Волжском регионе очень высока.
Результаты перечисленных исследований позволят врачу рекомендовать необходимое Вам лечение. Существуют 3 основных метода лечения глаукомы : медикаментозный, лазерный и хирургический.
Для диагностики применяется самое современное оборудование:
Диагностика глаукомы включает в себя стандартное офтальмологическое обследование (офтальмоскопия, биомикроскопия), исследование поля зрения (периметрия), исследование внутриглазного давления (компьютерную тоносфигмографию), оптическую когерентную томографию зрительного нерва, ультразвуковую биомикроскопию, осмотр угла передней камеры глаза (гониоскопию), различные нагрузочные и разгрузочные пробы для ранней диагностики глаукомы.
Для лечения глаукомы применяются:
Так же применяются такие методы лечения глаукомы, как консервативное лечение (подбор препаратов и режима их применения, который обеспечивает устойчивую компенсацию внутриглазного давления), лазерное лечение (лазерная трабекулопластика, иридэктомия, циклофотокоагуляция) и хирургические операции (непроникающая глубокая склерэктомия и глубокая склерэктомия, транссклеральное дренирование задней камеры глаза).
Операция непроникающей глубокой склерэктомии (НГСЭ), была предложена акад. С.Н. Федоровым (1986). Основными преимуществами НГСЭ являются: обеспечение управляемой фильтрации влаги мембраной, состоящей из десцеметовой оболочки и внутренней стенки шлеммова канала (трабекулы), которая регулирует мягкую фильтрацию влаги и устраняет резкие перепады ВГД в сторону гипотонии, приводящие к известным осложнениям; отсутствие перфорации глазного яблока, которое позволяет больному активно двигаться в ближайшие часы после операции, а операцию перевести в разряд амбулаторных; возможность усиления фильтрации влаги в разное время послеоперационного периода за счет YAG-лазерной перфорации «фильтрующей мембраны» (десцеметовой мембраны и трабекулы) в случаях декомпенсации ВГД.
Врачи участвуют в российских и зарубежных научных конференциях.
Сотрудниками клиники было получено 11 Патентов РФ на изобретения.
Тематика научных работ сотрудников — разработка и внедрение новых методов диагностики глаукомы, анализ эффективности методов ее лечения.
Так, защищены патентами РФ и внедрены в клиническую практику новейшие методики обследования пациентов с подозрением на глаукому: «Тоносфигмографический способ исследования индивидуально переносимого (толерантного) внутриглазного давления», «способ исследования чувствительности зрительного нерва к повышенному интолерантному внутриглазному давлению», «способ дифференциальной тонометрии», «способ прогнозирования первичной закрытоугольной глаукомы» и другие.
Оригинальный тоносфигмографический способ исследования индивидуально переносимого внутриглазного давления позволяет по показателям гемодинамики (кровотока) глаза определить у конкретного пациента верхнюю границу индивидуальной нормы внутриглазного давления, а следовательно более точно проводить у него лечение глаукомы.
Разработан способ, который позволяет исследовать чувствительность зрительного нерва к повышенному интолерантному внутриглазному давлению, проводить раннюю диагностику первичной глаукомы, дифференциальную диагностику между первичной глаукомой и глазной гипертензией, между глаукомой с нормальным давлением и псевдоглаукомой (ложной глаукомой). Способ основан на искусственном повышении внутриглазного давления и выявления дефектов в поле зрения с помощью уникальной компьютерной программы — статической селективной периметрии. «Способ дифференциальной тонометрии» позволяет точно измерить внутриглазное давление у пациента с учетом его индивидуальных особенностей глаза (с учетом толщины роговицы, переднезаднего размера и клинической рефракции глазного яблока). Исследование проводится на компьютерном тонографе по данным динамической дифференциальной тонометрии по Фриденвальду.
За работу « О толерантном и целевом внутриглазном давлении при первичной открытоугольной глаукоме» в 2008 г. получен Грант Российского глаукомного общества.
В 2010 году в Министерстве здравоохранения и социального развития утверждена медицинская технология «Тоносфигмографический метод определения толерантного и целевого внутриглазного давления у больных глаукомой» авторы Фокин В.П., Балалин С.В., Гущин А.В. (Номер и дата регистрации технологии в Росздравнадзоре: ФС-2010/321 от 03 сентября 2010 г.).
У Вас есть вопросы, пожелания или предложения, касающиеся работы всего филиала или отдельных его подразделений? Присылайте их по электронной почте.
Медикаментозное (консервативное) лечение первичной глаукомы
В настоящее время медикаментозное лечение глаукомы проводится по трем основным направлениям:
— терапия, направленная на снижение внутриглазного давления (офтальмогипотензивная терапия);
— терапия, способствующая улучшению кровоснабжения внутренних оболочек глаза и внутриглазной части зрительного нерва;
— терапия, направленная на нормализацию обменных процессов (метаболизма) в тканях глаза с целью воздействия на дистрофические процессы, характерные для глаукомы.
Необходимо сразу оговорить, что ключевым моментом в лечении глаукомы является нормализация уровня внутриглазного давления (ВГД), а методики, направленные на улучшение кровообращения и воздействие на обменные процессы в глазу носят лишь вспомогательный характер. Известное лечебное значение имеет правильный режим труда и жизни больного глаукомой.
Назначение лекарственных средств, снижающих уровень внутриглазного давления (ВГД), является прерогативой врача-офтальмолога, который при выборе того или иного препарата учитывает множество факторов. Нельзя заниматься самолечением, назначать самостоятельно или отменять антиглаукомные препараты или изменять кратность их закапывания, не проконсультировавшись со своим лечащим врачом!! Этими действиями вы можете нанести своим глазам непоправимый вред.
При назначении режима закапывания антиглаукомных капель, пациент должен динамически наблюдаться у врача в течение не менее 2-3 недель. В последующем, контроль за эффективностью лечения проводится не реже, чем 1 раз в 3 месяца.
Лазерно-хирургическое лечение глаукомы.
Лазерные методы коррекции внутриглазного давления (ВГД) и послеоперационных осложнений играют важную роль в комплексном лечении глаукомы. Следует отметить, что приоритет в разработке лазерных методов лечения в офтальмологии принадлежит отечественным ученым.
Преимущества лазерных вмешательств:
Основными видами лазерно-хирургического лечения глаукомы являются:
Лазерная иридэктомия (ЛИЭ)
Лазерная иридэктомия (ЛИЭ) — лазерная иридэктомия широко применяется с целью лечения закрытоугольной или узкоугольной глаукомы, острого приступа глаукомы или его профилактики. При помощи лазерного луча в области корня радужки формируется небольшое отверстие — колобома, через которое внутриглазная жидкость свободно проходит из задней камеры в переднюю, к путям оттока. Благодаря этому дополнительному пути для тока жидкости выравнивается давление между передней и задней камерой, корень радужки приоткрывает дренажную сеть, улучшается отток внутриглазной жидкости и снижается внутриглазное давление.
Даже при наличии нормального внутриглазного давления при закрытом или узком угле передней камеры в большинстве случаев требуется проведение лазерной иридотомии с целью профилактики острого приступа глаукомы.
Селективная лазерная трабекулопластика (СЛТ).
Проведение селективной лазерной трабекулопластики показано пациентам с открытоугольной глаукомой, предпочтительно в начальных стадиях процесса. Селективная трабекулопластика (СЛТ) обладает минимальным повреждающим эффектом на ткани угла передней камеры, что позволяет применять её неоднократно. СЛТ обладает высокоизбирательным механизмом действия, воздействуя только на клетки, содержищие пигмент, способствуя очищению и ремоделированию дренажной сети, что ведёт к улучшению оттока внутриглазной жидкости.
Показания к проведению селективной лазерной трабекулопластики:












 Корнеальный гистерезис (КГ) – это оценка способности роговицы поглощать и рассеивать энергию. Это очень отличается от толщины или топографии, которые являются геометрическими показателями роговицы. КГ — разница между двумя регистрируемыми ORA (Ocular Response Analyzer) значениями давления во время аппланации роговицы, возникающими в результате затухания воздушного импульса в вязко–эластичной роговичной ткани. Фактор резистентности роговицы – дополнительный параметр, который рассчитывается с помощью специального алгоритма.
Корнеальный гистерезис (КГ) – это оценка способности роговицы поглощать и рассеивать энергию. Это очень отличается от толщины или топографии, которые являются геометрическими показателями роговицы. КГ — разница между двумя регистрируемыми ORA (Ocular Response Analyzer) значениями давления во время аппланации роговицы, возникающими в результате затухания воздушного импульса в вязко–эластичной роговичной ткани. Фактор резистентности роговицы – дополнительный параметр, который рассчитывается с помощью специального алгоритма.