Сонография поджелудочной железы что это
Эндосонография
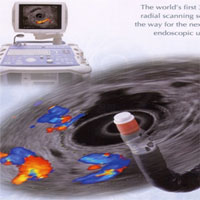
Исследование проводится при помощи видеоэндоскопа, на конце которого расположен радиально сканирующий ультразвуковой датчик. Использование в приборе очень высоких частот ультразвука (5,0; 7,5; 12 и 20 МГц) обеспечивает высокое качество изображения с разрешающей способностью менее 1 мм, недоступное другим методам исследования, таким как обычное ультразвуковое исследование, компьютерная и магнитно-резонансная томография, эндоскопическая холангиопанкреатикография. При этом эндосонография не сопряжена с риском рентгенологического облучения персонала и пациента, отсутствует опасность возникновения осложнений, свойственных ЭРХПГ.
Преимущества эндоскопического ультразвука перед традиционным ультразвуковым исследованием через переднюю стенку живота заключаются в том, что ультразвуковой датчик по просвету пищеварительной трубки под визуальным контролем можно провести непосредственно к исследуемому объекту.
Стенка пищеварительной трубки при ультразвуковой визуализации представляется в виде чередующихся темных и светлых полосок, каждая из которых соответствует слизистому, подслизистому, мышечному, адвентициальному слоям с их прослойками. Утолщение определенных слоев, нарушение их регулярности, четкости границ и прочие изменения позволяют определить наличие патологического очага и оценить его распространение вглубь стенки и за её пределы. Применение эндосонографии при опухолевых заболеваниях органов брюшной полости дает возможность обнаружить измененные регионарные лимфатические узлы.
Основные показания к применению эндосонографии:
Эндоскопическая ультрасонография (эндоУЗИ)
Эндоскопическое ультразвуковое исследование (ЭндоУЗИ) ПРОВОДИТСЯ ТОЛЬКО В СОСТОЯНИИ МЕДИКАМЕНТОЗНОГО СНА.
Показания и область применения ЭндоУЗИ:
Для исключения противопоказаний к проведению эндоУЗИ необходимо предварительно сделать гастроскопию. При заболеваниях пищевода может понадобиться рентгенологическое исследование пищевода с барием или компьютерная томография (КТ) грудой клетки. При заболеваниях брюшной полости (поджелудочной железы, желчных протоков и др.) предварительно проводится обычное ультразвуковое исследование брюшной полости, но в некоторых случаях уместно выполнить КТ брюшной полости.
Подготовка к исследованию
ЭНДОУЗИ проводится строго натощак – последний прием пищи накануне до 20.00. Если Вы курите, за 2 часа до исследования воздержитесь от курения. Врач-эндоскопист обязательно должен быть осведомлен о наличии у пациента сопутствующих заболеваний (например, сахарный диабет) и о наличии аллергии на лекарственные препараты.
ЭНДОУЗИ выполняется только в медикаментозном сне (внутривенная анестезия), для чего может потребоваться следующее дообследование (по показаниям):
Все эндоскопические исследования выполняются эндоскопами новейшего поколения фирмы Olympus (Japan), врачами-эндоскопистами, обучавшимися и работавшими за рубежом.
Результаты обследования предоставляются в течение 24 часов после окончания процедуры в печатном виде в соответствие с мировыми стандартами, эндофотографиями и DVD-диском.
Дезинфекция и стерилизация эндоскопов и инструментов проводится в соответствии с международными стандартами, с использованием полностью автоматических машин, исключающих передачу инфекции, с формированием протокола дезинфекции.
Эндоскопическое ультразвуковое исследование
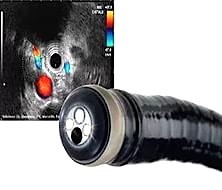
На отделении эндоскопии НМИЦ онкологии им. Н.Н. Петрова исследования проводится с помощью современного ультразвукового комплекса Hitachi-Pentax. Среди дополнительных возможностей этого прибора есть такие как эластография (технология оценки эластичности тканей), цветовой и энергетический допплер (позволяют проследить кровоток в органе). Отделение оснащено ультразвуковыми эндоскопами с датчиками 2-х разных типов: радиальным (используется в целях диагностики) и конвексным (применяется для лечебных процедур).
Показания для выполнения ЭУС:


Эндосонография позволяет визуализировать опухоли поджелудочной железы небольших размеров (менее 3 см), недоступные для стандартного УЗИ и методов компьютерной диагностики, и более точно, чем ангиография, определить инвазию опухоли в сосудистые структуры, что крайне важно для определения возможности хирургического лечения.
Специалисты нашего отделения выполняют эндоУЗИ панкреато-билиарной области не только при доброкачественных или злокачественных новообразованиях, но также и кистах (с целью дифференциальной диагностики с кистозными неоплазиями), остром и хроническом панкреатите (при неясной клинической ситуации и невозможности с помощью прочих методов отличить воспалительные изменения от опухолевых).
Речь идет о дифференциальной диагностике образований желчного пузыря (полипы, аденомиоз, билиарный сладж, конкременты, воспалительные изменения стенки желчного пузыря) и выявлении патологии внепеченочных желчных протоков (опухоли, доброкачественные сужения, конкременты). Метод особенно важен для диагностики поражений терминальных отделов желчного и панкреатического протоков и Фатерова сосочка. Эти зоны малодоступны для других методов диагностики, а новообразования этой области (как доброкачественные, так и злокачественные) встречаются не редко.
Противопоказания для выполнения ЭУС:
Крайне тяжелое общее состояние пациента, которое не дает возможности проводить эндоскопическое исследование верхних отделов пищеварительного тракта без угрозы угнетения дыхания и сердечной деятельности.
Выраженные изменения свертывающей системы крови (если планируются оперативные манипуляции).
Технические ограничения для выполнения ЭУС
Если Вам выполнялись оперативные вмешательства на органах желудочно-кишечного тракта, а также имеются анатомические особенности строения пищевода или желудка, сообщите об этом доктору заранее и покажите выписные справки.
Как осуществляется исследование
Специалисты нашего отделения рекомендуют выполнять процедуру эндоУЗИ под общей анестезией, препараты для которой вводятся внутривенно, т.к. беспокойное поведение пациента может значительно затруднить работу врача и отрицательным образом повлиять на результат обследования.
После процедуры, выполняемой под наркозом, в течение одного часа у Вас может ощущаться сонливость, вялость. Когда вы полностью восстановитесь, врач обсудит с Вами результаты процедуры.
Оперативные вмешательства под эндоУЗИ-контролем
Как и другие эндоскопические процедуры, эндоУЗИ является безопасным исследованием и хорошо переносится. Однако, как и при других медицинских процедурах иногда возникают осложнения. Частота осложнений при эндоУЗИ без проведения тонкоигольной биопсии составляет около 1 случая из 2000 исследований, что сравнимо с частотой осложнений при ФГС.
Основными серьезными осложнениями могут быть:
Специалисты отделения эндоскопии настоятельно рекомендуют выполнять диагностическое исследование под внутривенной анестезией. Оперативные вмешательства под эндоУЗИ-контролем выполняются под наркозом в обязательном порядке. Для выполнения некоторых лечебных вмешательств может потребоваться госпитализация в стационар.
Для решения вопроса о выполнении оперативного вмешательства под эндоУЗИ-контролем необходима консультация заведующего отделением эндоскопии Ткаченко О.Б.
УЗИ поджелудочной железы
Поджелудочная железа очень важна в системе пищеварения. Многие заболевания негативно сказываются на работе данного органа, что негативно сказывается на организме в целом. Одним из эффективных способов проверки поджелудочной железы является ультразвуковая диагностика (УЗИ). Данная методика полностью безопасна и может проводиться как взрослым, как и детям.
Местонахождение поджелудочной железы в организме человека
Поджелудочная находится сзади от желудка с левой стороны, очень плотно прилегает к двенадцатиперстной кишке, а также находится под надежной защитой ребер. Почему роль поджелудочной железы так важна в пищеварении? Дело в том, что в ней выделяется около двух литров в день панкреатического сока, благодаря которому осуществляется процесс переваривания пищи.
Самой толстой частью органа является головка, затем она переходит в тело и хвост, конец которого расположен около селезенки. Поджелудочную железу покрывает особая оболочка.
Стоит отметить, что здоровье органа непосредственно связано с мочевыводящими путями.
Когда назначают УЗИ поджелудочной железы:
Поджелудочную железу необходимо проверить путем УЗИ-диагностики, если пациент:
При наличии патологии в лабораторных исследованиях в обязательном порядке назначается ультразвуковая диагностика поджелудочной. Помимо этого, диагностика железы назначается после перенесения таких заболеваний как: гепатит A, С, B.
Иные ситуации, в которых требуется проведение УЗИ поджелудочной железы:
В рамках исследования поджелудочной осуществляется полная диагностика брюшной полости. Исследование позволяет выявить патологии на самой начальной стадии. Это поможет в кратчайшее время назначить лечение и избежать развития болезни. Ведь болезни железы напрямую влияют на здоровье других органов.
Ультразвуковое исследование поджелудочной железы рекомендуется проходить один раз в год всем людям старше 25 лет.
Что входит в подготовку к УЗИ.
Для получения достоверного результата во время диагностики, следует соблюдать все правила подготовки к ней. При пренебрежении правилами, возможно искажение результатов исследования или возникновение трудностей во время УЗИ. В первую очередь, следует полностью очистить кишечник путем клизмы или приема слабительных средств. За два дня до исследования разрешено принимать сорбенты, способствующие снижению образования газов.
За двое суток до УЗИ следует полностью убрать из рациона:
Можно употреблять крупы, фрукты, которые прошли термическую обработку, мед.
Прием пищи позднее чем за 12 часов до исследования недопустим.
Лучше спланировать обследование на первую половину дня, потому как есть и пить до обследования в этот день не разрешается. Запрещено также жевание жвачки и курение. Если вы принимаете лекарственные препараты, обязательно узнайте у врача, как их следует принимать до УЗИ.
Что нужно иметь ввиду, если нужно проверить поджелудочную железу:
В некоторых случаях специальная диета назначается только доктором, это зависит от индивидуальных особенностей организма;
При наличии лишнего веса, клизму следует сделать 2 раза: накануне процедуры и в день проведения исследования.
При несоблюдении всех рекомендаций, результат УЗИ потеряет свою информативность на 50%.
Как проходит УЗИ поджелудочной
Поджелудочную железу посредством ультразвука диагностируют в течение 30-60 минут. Процедура проводится лежа на спине. На живот наносится специальный гель. Затем врач-узи при помощи специального датчика начинает проводить исследование. При необходимости доктор может попросить пациента втянуть или надуть живот.
В ходе УЗИ пациенту нужно будет лечь сначала на правый, а потом на левый бок, в некоторых случаях врач просит встать пациента на ноги. Это требуется для того, чтобы как можно тщательнее исследовать поджелудочную железу.
Сразу после выполнения УЗИ врач выдает пациенту расшифровку, при необходимости комментирует те или иные пункты, чтобы акцентировать на них внимание пациента.
Болезни, которые можно выявить посредством диагностики поджелудочной ультразвуком.
На появление панкреатита в острой стадии указывает снижение эхо-сигнала. При этом железа становится полностью белой. Если картинка становится менее интенсивной, это может свидетельствовать о наличии отека поджелудочной железы.
О наличии новообразований в поджелудочной может говорить отклонение ее хвоста. Если эхо-сигнал становится сильнее, то это может говорить о хронической стадии панкреатита или наличии онкологии. В местах ее появления цвет поджелудочной будет отличаться от основного.
Если размер печени или желчного пузыря увеличивается, это тоже может говорить о наличии новообразований. Для выявления его этиологии кусочек ткани отправляется на гистологическое исследование.
Абсцессы, которые способствуют появлению полостей с мутным экссудатом говорят о панкреонекрозе. Если расширился вирсунгов проток, это может свидетельствовать о воспалительном процессе железы.
Стоит отметить, что многие опасные болезни могут никак себя не проявлять на первых этапах, но диагностироваться в рамках УЗИ. Поэтому ни в коем случае нельзя игнорировать исследование, если оно было назначено доктором.
Какие показатели считаются нормой?
УЗИ поджелудочной позволяет дать оценку состоянию здоровья органа. Ниже приведены нормальные показатели поджелудочной у взрослых пациентов:
Нормальные показатели взрослого человека отличаются от показателей, присущим ребенку.
Еще раз хотим отметить, что диагностика поджелудочной железы осуществляется в рамках комплексной УЗИ-диагностики брюшной полости. Это связано с тем, что довольно сложно при помощи УЗИ выявить болезни поджелудочной, но зато можно диагностировать болезни органов, граничащих с ним, что позволяет дать оценку общего состояния брюшной полости. При выявлении отклонений во время УЗИ врач назначает дополнительные исследования.
Диагностика поджелудочной ультразвуковым методом дает возможность безопасно и за короткий промежуток времени обнаружить болезнь еще на начальной стадии и своевременно ее предотвратить.
УЗИ поджелудочной железы в Н. Новгороде
Диагностика поджелудочной железы в нашем городе проводится в клинике «Академия VIP». Исследование выполняется врачами, имеющим опыт более 15 лет. Все они являются сертифицированными специалистами. В клинике имеется два высокотехнологичных аппарата УЗИ, на которых выполняется исследование. Оборудование дает возможность максимально точно оценить состояние поджелудочной железы и расположенных рядом органов. Стоимость диагностики является среднегородской.
Узнать более подробную информацию об исследовании, а также записаться на УЗИ можно у администраторов клиники «Академия VIP». Номер телефона: +7 (831) 200-47-38.
Сонография поджелудочной железы что это
Московский клинический научно-практический центр Департамента здравоохранения Москвы, Москва, Россия
ГБУЗ «Московский клинический научно-практический центр им. А.С. Логинова» Департамента здравоохранения Москвы, Москва, Россия
ГБУЗ «Московский клинический научно-практический центр им. А.С. Логинова» Департамента здравоохранения Москвы, Москва, Россия
ГБУЗ «Московский клинический научно-практический центр им. А.С. Логинова» Департамента здравоохранения Москвы, Москва, Россия
ГБУЗ «Московский клинический научно-практический центр им. А.С. Логинова» Департамента здравоохранения Москвы, Москва, Россия
Эндоскопическая ультрасонография с контрастным усилением в дифференциальной диагностике заболеваний поджелудочной железы
Журнал: Доказательная гастроэнтерология. 2018;7(4): 35-43
Коваленко Д. Д., Быстровская Е. В., Пронина Г. М., Орлова Ю. Н., Абдураимов А. Б. Эндоскопическая ультрасонография с контрастным усилением в дифференциальной диагностике заболеваний поджелудочной железы. Доказательная гастроэнтерология. 2018;7(4):35-43.
Kovalenko D D, Bystrovskaya E V, Pronina G M, Orlova Yu N, Abduraimov A B. Contrast-enhanced endoscopic ultrasonography in differential diagnosis of pancreatic diseases. Russian Journal of Evidence-Based Gastroenterology. 2018;7(4):35-43.
https://doi.org/10.17116/dokgastro2018704135
Московский клинический научно-практический центр Департамента здравоохранения Москвы, Москва, Россия
В настоящее время все более весомое значение в решении сложных задач дифференциальной диагностики заболеваний панкреатобилиарной системы отводится эндоскопической ультрасонографии (ЭУС, EUS). Развитие технологий УЗИ способствовало внедрению в клиническую практику методики контрастного усиления (CH). Эндосонография, дополняемая контрастированием изучаемого объекта, значительно увеличивает информативность метода, расширяет возможности дифференциальной диагностики как солидных, так и кистозных образований поджелудочной железы. Актуальной задачей является оценка диагностической точности и определение места ЭУС-контрастного усиления (CH-EUS) в диагностическом алгоритме обследования пациентов с заболеваниями поджелудочной железы. В статье приведен обзор результатов использования CH-EUS европейскими и японскими исследователями.
Московский клинический научно-практический центр Департамента здравоохранения Москвы, Москва, Россия
ГБУЗ «Московский клинический научно-практический центр им. А.С. Логинова» Департамента здравоохранения Москвы, Москва, Россия
ГБУЗ «Московский клинический научно-практический центр им. А.С. Логинова» Департамента здравоохранения Москвы, Москва, Россия
ГБУЗ «Московский клинический научно-практический центр им. А.С. Логинова» Департамента здравоохранения Москвы, Москва, Россия
ГБУЗ «Московский клинический научно-практический центр им. А.С. Логинова» Департамента здравоохранения Москвы, Москва, Россия
В настоящее время все более весомое значение в диагностике заболеваний поджелудочной железы (ПЖ) отводится эндоскопической ультрасонографии (ЭУС, EUS). Несмотря на широкое внедрение метода, основной проблемой остается дифференциальная диагностика воспалительных и опухолевых изменений паренхимы ПЖ. С развитием медицинских технологий появилась перспектива внедрения в клиническую практику новых методик, выполняемых при эндоскопическом ультразвуковом исследовании, таких как контрастное усиление. Указанная методика значительно расширяет возможности дифференциальной диагностики как солидных, так и кистозных образований ПЖ[1—3].
По данным европейских и японских исследователей [4—7], ЭУС с контрастированием (CH-EUS) является принципиально новым методом эндосонографической диагностики, позволяющим провести качественный и количественный анализ степени васкуляризации исследуемого объекта, что способствует объективной диагностике непосредственно во время эндоскопического ультразвукового исследования.
История внедрения метода в клиническую практику
Впервые применение контрастного вещества при УЗИ было описано в 1969 г., когда кардиолог Claude Joyner (цит. по [8]) заметил необычное увеличение сигнала при исследовании аорты в М-режиме в ходе ангиографических процедур непосредственно в момент введения рентгеноконтрастного вещества. Усиление УЗ-сигнала было обусловлено присутствием свободных микропузырьков газа, образующихся в момент инъекции, а также содержащихся в растворе препарата. Но лишь в 1980 г. в клиническую практику стал внедряться метод контрастирования с помощью химических средств.
Практическое использование контрастов для усиления эхосигнала началось в 1982 г. при эхокардиографии [9]. В 1990 г. появилось первое поколение ультразвуковых аппаратов с контрастным усилением для исследования брюшной полости [10]. Первые положительные результаты использования контраста при УЗИ печени дали начало активного применения этой технологии для других паренхиматозных органов [11].
Газовые пузырьки контрастного вещества первого поколения не были достаточно устойчивыми для непрерывного ультразвукового сканирования. В 2001—2002 гг. было введено в использование новое поколение контрастных веществ на основе высокоплотных газов (SonoVue и др.), которые не выходят за пределы кровеносного русла, а их распределение в организме полностью совпадает с распределением эритроцитов [12]. В последующем на основе биополимеров (Sonovist) были разработаны препараты третьего поколения, состоящие из заполненных газом микросфер, средний диаметр которых составляет 1 мкм. Оболочка микропузырька представляет собой тончайший слой саморазрушающегося полимера. Препарат стабилен в течение нескольких часов и избирательно накапливается в печени и селезенке.
Поскольку при обычной частоте ультразвуковой волны разрушение микропузырьков происходило очень быстро, производители ультразвуковой аппаратуры предусмотрели специальный режим получения изображений при низком механическом индексе (МИ) для использования контрастного вещества [13]. Этот режим позволил поддерживать колебания микропузырьков и визуализировать их в паренхиматозной ткани в режиме реального времени. Благодаря возможности непрерывного ультразвуковое сканирования в период притока контрастного вещества и его распределения в тканях оценивается динамика контрастного усиления.
В 2005 г. C. Dietrich и соавт. [14] сообщили о первом использовании контрастного усиления при ЭУС с низким МИ у 6 пациентов. Первый опыт CH-EUS с использованием нового линейного прототипа эхоэндоскопа представили M. Kitano и соавт. [15]. Первоначально они проводили эксперименты на животных моделях, затем на 2 пациентах, один из которых имел рак ПЖ, а другой — гастроинтестинальную стромальную опухоль. Исследователи сделали вывод о возможной роли CH-EUS при исследовании некоторых заболеваний пищеварительного тракта. Далее те же авторы [16] продолжили исследование, чтобы оценить потенциал CH-EUS в клиническом применении. В общей сложности были проанализированы результаты обследования 104 пациентов, после чего был сделан вывод, что СН-EUS является перспективным неинвазивным методом для оценки перфузии и микроциркуляции в паренхиме ПЖ и играет важную роль в дифференциальной диагностике.
Клиническое применение контрастного усиления в диагностике солидных образований поджелудочной железы
Основными задачами, стоящими перед исследователями, изучающими эффективность метода в диагностике патологических изменений ПЖ, являются:
— оценка эффективности CH-EUS в точности диагностики солидных и кистозных панкреатических образований;
— определение объективных параметров степени васкуляризации паренхиматозной ткани, динамики притока и оттока контрастного вещества (wash-in и wash-out);
— определение роли CH-EUS при проведении тонкоигольной пункции при ЭУС (EUS-FNA);
— оценка преимуществ CH-EUS перед другими методами исследования.
CH-EUS в диагностике солидных образований поджелудочной железы
Диагностика солидных образований ПЖ до сих пор остается актуальной проблемой. Несмотря на новые достижения в визуализации, не существует идеального метода для дифференциальной диагностики образований ПЖ. «Золотым стандартом» диагностики является EUS-FNA, предоставляющая гистологический материал. Однако EUS-FNA может дать ложные результаты из-за ошибок выборки.
ЭУС превосходит все другие методы визуализации в выявлении мелких панкреатических злокачественных образований, но его возможности ограничены: карциномы, нейроэндокринные опухоли, воспалительные инфильтраты и псевдоопухоли, как правило, представлены гипоэхогенными образованиями. Контрастное усиление облегчает их верификацию.
P. Fusaroli и соавт. [17] связали гиповаскуляризацию протоковой аденокарциномы с наличием диспластических изменений (чувствительность 96% и специфичность 82%). Нейроэндокринные опухоли в 9 из 11 случаев были гиперваскулярны, в то время как васкуляризация хронического панкреатита в большинстве случаев была эквивалентна нормальной паренхиме. При исследовании 10 пациентов M. Hocke и соавт. [18] сделали вывод, что зоны аутоиммунного воспаления также гиперваскулярны при CH-EUS, как и визуально неизмененная паренхима ПЖ.
T. Ishikawa и соавт. [19] исследовали роль CH-EUS в определении локализации нейроэндокринных опухолей (НЭО) ПЖ и дифференциальной диагностике злокачественных и доброкачественных НЭО. CH-EUS показала высокую чувствительность (95,1%) в определении НЭО по сравнению с мультиспиральной компьютерной томографией (МСКТ) — 80,6% и УИ — 45,2%. К наиболее важному фактору злокачественности опухоли они отнесли гетерогенную эхоструктуру опухоли.
По данным нескольких исследователей (P. Fussarol, B. Napoleon, M. Kitano, R. Gincul и соавт.), гиповаскуляризация при CH-EUS расценивается как признак злокачественности новообразования с высокой чувствительностью (89—96%), специфичностью от 65 до 94%, достоверностью от 82 до 94% (см. рисунок) 
M. Alvarez-Sánchez и B. Napoléon [21] визуализировали аденокарциному при CH-EUS как неоднородное гиповаскулярное образование с высокой чувствительностью (89—95%) и специфичностью (64—89%), в то время как нейроэндокринная опухоль выглядела гиперваскулярной также с высокой чувствительностью и специфичностью (79—99% соответственно).
A. Seicean и соавт. [22] провели исследование, в котором впервые оценили показатель коэффициента поглощения (кривая интенсивности) time intensity curve (TIC) после введения контраста при CH-EUS. В 14 случаях аденокарцином и 10 случаях хронического панкреатита CH-EUS показало гиповаскуляризованные поражения. Индекс коэффициента поглощения контрастного вещества был значительно ниже при аденокарциноме, чем при псевдотуморозном панкреатите. Результаты данного исследования показали, что количественная оценка CH-EUS может значительно улучшить дифференциальную диагностику злокачественных и доброкачественных образований П.Ж. Оценку кривой интенсивности при CH-EUS также провел D. Gheonea и соавт. [23]. Они провели сравнительный анализ васкуляризации при хроническом псевдотуморозном панкреатите и раке ПЖ с последующим анализом динамики притока (wash-in) и оттока (wash-out) контрастного вещества. Чувствительность, специфичность, положительное и отрицательное прогностические значения CH-EUS с анализом TIC были 93,75, 89,47, 93,75 и 89,47% соответственно. В большинстве случаев псевдотуморозного хронического панкреатита наблюдалась гиперваскуляризация в ранней артериальной фазе контрастного усиления с последующим выравниванием рисунка (аналогично окружающей паренхиме). В общей сложности 30 аденокарцином из 32 показали слабое накопление контраста как во время ранней артериальной, так и во время поздней венозной фазы, что характерно для гиповаскулярного образования. Оставшиеся 2 случая показали первоначальное гиперусиление с последующим быстрым оттоком контрастного вещества.
M. Kitano и соавт. [20] обнаружили, что CH-EUS является более точным методом в диагностике небольших образований ПЖ (протоковые аденокарциномы и мелкие нейроэндокринные опухоли), чем МСКТ. Для выявления небольших карцином с помощью CH-EUS чувствительность и специфичность составили 91,2 и 94,4% соответственно. Гиперваскулярное образование при CH-EUS было расценено как нейроэндокринная опухоль с чувствительностью и специфичностью 78,9 и 98,7% соответственно. В результате при CH-EUS было обнаружено 12 образований размером менее 2 см, которые не были выявлены при МСКТ (10 аденокарцином и 2 НЭО).
Y. Yamashita и соавт. [24] провели CH-EUS 39 больным с неоперабельным раком ПЖ, у которых был запланирован курс химиотерапии. По их предположению, опухоли, имеющие в своей структуре сосуды, более химиочувствительны. Авторы пришли к выводу, что оценка внутриопухолевых сосудов при помощи CH-EUS может быть полезна для прогнозирования эффективности химиотерапии. Выживаемость без прогрессирования болезни и общая выживаемость были значительно выше у пациентов с внутриопухолевыми крупными сосудами.
A. Săftoiu и соавт. [25] в своем исследовании оценили параметры, полученные из анализа TIC (кривая интенсивность во времени) в модели искусственной нейронной сети (ИНС) (artificial neural network ANN) для дифференциальной диагностики карциномы ПЖ (PC) и хронического панкреатита (СР). В общей сложности были обследованы 167 пациентов с PC (n=112) или CP (n=55). EUS-FNA была проведена 129 пациентам. Чувствительность (Se) и специфичность (Sp) составили 84,82 и 100% соответственно, в то время как положительная (PPV) и отрицательная прогностическая ценность (NPV) были 100 и 76,63% соответственно. Чувствительность в режиме реального времени количественной оценки CH-EUS была 87,5%, специфичность 92,72%, PPV 96,07% и NPV 78,46%. Пик васкуляризации, зона накопления контрастного вещества на кривой, скорость накопления, а также индекс перфузии значительно отличались между группами. Никаких существенных различий не было обнаружено между временем нарастания, среднего времени транзита и времени до пика накопления вещества. Для ИНС чувствительность составила 94,64%, специфичность 94,44%, PPV 97,24% и NPV 89,47% (табл. 1). 
Таким образом, параметры, полученные с помощью анализа кривой интенсивности во времени (TIC), можно использовать для дифференциальной диагностики случаев рака ПЖ и хронического панкреатита с хорошим эффектом, в том числе в автоматизированной диагностической системе с хорошими диагностическими результатами.
Клиническое применение контрастного усиления в диагностике кистозных образований поджелудочной железы
Кистозные образования ПЖ включают большое разнообразие поражений со схожими сонографическими особенностями, но различными морфологическими характеристиками, и их точная предоперационная диагностика остается сложной до настоящего момента. Во время CH-EUS васкуляризированные структуры кистозных поражений постепенно становятся эхогенными, в то время как содержимое кист (сгустки крови, «сладж» и муцин) полностью невидимо. Это может улучшить диагностику псевдокист, кистозных неоплазий и дифференциальную диагностику доброкачественных и злокачественных внутрипротоковых папиллярных муцинозных неоплазий (IPMN).
По мнению M. Tanaka и соавт. [26], наличие нодулярного компонента IPMN является одним из наиболее важных критериев для принятия решений о хирургическом вмешательстве.
Позже Американская гастроэнтерологическая ассоциация также отнесла солидный компонент к одному из трех факторов риска, которые учитываются при резекции кисты [27].
МСКТ и EUS для дифференциальной диагностики солидного компонента и муцинозных сгустков считаются недостаточно эффективными [28]. Поэтому важными стали результаты первых использований CH-EUS при IPMN, о которых сообщалось на Digestive Disease Week (DDW) в 2008 и 2009 г. [29, 30]. Были предоставлены результаты CH-EUS у 75 пациентов с IPMN. При исследовании у 28 пациентов было обнаружено усиленное накопление контраста солидного компонента, что по результатам операции соответствовало аденоме или участку малигнизации. У 6 из этих пациентов оказалась инвазивная карцинома с сочетанием гиперваскулярных папиллярных разрастаний и гиповаскулярных зон некроза.
Подтверждение этих данных было получено в проспективном исследовании Y. Yamashita и соавт. [31], проводивших CH-EUS на 17 пациентах, которые имели IPMN с нодулярным компонентом. Чувствительность, специфичность, PPV, NPV и достоверность CH-EUS для обнаружения солидного компонента составили 100, 80, 92, 100 и 94% соответственно. В отличие от этого 5 (в 3 случаях из них размеры превышали 10 мм) из 12 нодулярных компонентов не были обнаружены при МСКТ.
Сравнение фундаментального В-режима ЭУС (FB-EUS) и контраст-усиленной ЭУС (CH-EUS) в дифференциальной диагностике панкреатических кист при наличии нодулярного компонента провели K. Kamata и соавт. [32]. Проспективно были проанализированы данные 581 пациента с панкреатическими кистами, а также ретроспективно — 70 пациентов с последующей резекцией кист. Оценивались наличие и размер нодулярных компонентов, обнаруженных при FB-EUS и CH-EUS, а также точность обоих методов для дифференциальной диагностики муцинозных и немуцинозных злокачественных и доброкачественных кист (табл. 2, 3). 

Результаты исследования показали, что CH-EUS точнее распознает и дифференцирует нодулярные компоненты и сгустки слизи, а также лучше различает злокачественные и доброкачественные кисты ПЖ, чем FB-EUS. При анализе данных было установлено, что для дифференцировки доброкачественных и злокачественных кист оптимальное пороговое значение размеров солидного компонента должно быть не менее 4 мм. Эти преимущества могут помочь уменьшить число ненужных хирургических процедур у больных с доброкачественными кистозными неоплазиями.
В недавнем исследовании P. Fusaroli и соавт. [33] с участием 76 пациентов с кистозными образованиями ПЖ оценивали стенки кист, перегородок и солидный компонент при CH-EUS. Серозные и муцинозные кисты были гиперэхогенными (86 и 89% соответственно) в то время как псевдокисты были гипоэхогенными в 90% случаев. В случаях гиперваскулярных нодулярных компонентов была выявлена малигнизация (2 злокачественные внутрипротоковые папиллярные муцинозные неоплазии, 2 кистозные нейроэндокринные опухоли). Выявленные гипоэхогенные пристеночные компоненты в результате оказались сгустками слизи в доброкачественных кистах или внутриполостным сладжем в псевдокистах. Авторы пришли к выводу, что CH-EUS эффективна в дифференциальной диагностике псевдокист и кистозных неоплазий, а также для определения солидного компонента и кистозного содержимого.
N. Yamamoto и соавт. [34] провели исследование для оценки точности CH-EUS с анализом кривой интенсивности во времени и васкуляризации солидного компонента для различения низкой или средней дисплазии (LGD/IGD) и высокой степени дисплазии или инвазивной карциномы (HGD/инвазивной карциномы) в IPMN. Показатели изменения эхо-интенсивности (от базовой до пиковой интенсивности), скорость снижения интенсивности эхосигнала, а также коэффициент контрастирования нодулярного компонента/паренхимы ПЖ были значительно выше в группе HGD/инвазивной карциномы, чем в группе LGD/IGD (достоверность этих параметров была 80, 86,7 и 93,3% соответственно). Васкуляризация нодулярного компонента также была значительно выше в группе HGD/инвазивной карциномы. Авторы пришли к выводу, что количественная оценка накопления контрастного вещества для IPMN полезна для дифференциальной диагностики HGD/инвазивной карциномы и LGD/IGD (табл. 4). 
Контрастное усиление притонкоигольной пункции под контролем эндоскопической ультрасонографии
EUS-FNA является «золотым стандартом» в диагностике образований П.Ж. Однако материала биопсии иногда бывает недостаточно для соответствующего патологического диагноза, и ложноотрицательные результаты могут достичь 20—40% [35]. Кроме того, проведение EUS-FNA ПЖ связано с возможными осложнениями (острый панкреатит, кровотечение, присоединение инфекции, перфорация и т. д.) [36].
В настоящее время одной из основных ролей CH-EUS является уточнение диагностической интерпретации FNA, в частности, при отрицательных результатах биопсии. Например, в случаях гипоконтрастирования образования ПЖ, характерного для аденокарциномы, и получении отрицательной FNA появляется еще один аргумент в пользу необходимости повторной биопсии. С другой стороны, сочетание изоинтенсивного контрастирования (характерного для доброкачественных изменений) и отрицательного результата FNA может быть более убедительным. Также контрастное усиление может помочь в выборе направления иглы в пределах конкретного образования.
Некоторыми авторами были проведены исследования, целью которых было изучение эффективности контрастного усиления при EUS-FNA (CH-EUS-FNA) в сравнении с обычным EUS-FNA для диагностики солидных образований ПЖ.
M. Kitano и соавт. [20] в своем исследовании пришли к выводу, что сочетание CH-EUS и EUS-FNA полезно для точной диагностики рака П.Ж. При CH-EUS протоковые карциномы, результаты которых при EUS-FNA оказались ложноотрицательными, были гиповаскуляризованы, что соответствовало их злокачественности. Использование контрастного усиления при EUS-FNA увеличило чувствительность EUS-FNA от 92,2 до 100%. К такому же выводу пришли и R. Gincul и соавт. [7] при исследовании 100 пациентов с солидными образованиями П.Ж. Пять ложноотрицательных случаев после EUS-FNA были правильно диагностированы при использовании CH-EUS. Сравнительный анализ данных исследований в диагностике аденокарцином представлен в табл. 5. 
Как правило, для получения адекватных проб из опухоли ПЖ необходимо несколько проходов иглы при EUS-FNA из-за частого присутствия фиброза и некроза без каких-либо жизнеспособных клеток. Одновременная визуализация микроциркуляции с помощью CH-EUS поможет избежать ложноотрицательных результатов из-за контаминации материала эритроцитами (в гиперинтенсивных областях) или из-за некроза или фиброза (в областях без сигнала).
M. Sugimoto и соавт. [37] исследовали 40 пациентов: 20 из них подверглись CH-EUS-FNA, а другие 20 прошли традиционную EUS-FNA. В результате достаточный образец после первого прохода иглы был получен в 12 (60%) случаях из 20 в группе с CH-EUS-FNA по сравнению с 5 (25%) из 20 в группе с EUS-FNA. Авторы пришли к выводу, что CH-EUS-FNA является более эффективным и безопасным методом за счет меньшего числа необходимых проходов иглы для набора хорошего диагностического материала.
X. Hou и соавт. [38] провели такой же сравнительный анализ и получили чувствительность 81,6%, специфичность 100%, PPV и NPV 100 и 74,1% соответственно, а также достоверность 87,9% при CH-EUS-FNA. Доля адекватных биоптатов при контрастировании была выше, чем без него (96,6 и 86,7% соответственно).
P. Fusaroli и M. Eloubeidi [39] отметили важность дальнейших исследований для определения роли контрастного усиления для упрощения постановки верного диагноза и для выбора фокуса при EUS-FNA, снижения числа ложноотрицательных результатов EUS-FNA.
Развитие хирургии в онкологии в последние годы определяют повышенные требования к дооперационному обследованию пациентов, при этом важно детально описать заболевание, степень изменения пораженного органа и вовлечение окружающих структур, провести дифференциальную диагностику и предоставить необходимые данные для определения лечебной тактики, планирования типа предстоящего вмешательства и выбора хирургического доступа. В современных российских и зарубежных научных изданиях существует большое количество работ, показывающих эффективность эндосонографии в диагностике протоковой аденокарциномы и нейроэндокринных опухолей, дифференциальной диагностике псевдокист и кистозных неоплазий П.Ж. Первые полученные результаты европейских и японских исследователей свидетельствуют об очевидной дополняющей роли контрастного усиления, использование которого объективизирует диагноз и расширяет возможности эндоскопического УЗИ для определения дальнейшей тактики лечения. Однако на сегодняшний день метод недостаточно хорошо изучен, не установлены стандарты в дифференциальной диагностике очаговых поражений (кистозные и солидные) П.Ж. Таким образом, абсолютно очевидна необходимость дальнейшего внедрения нового метода ЭУС в клиническую практику, что обосновано новыми открывающимися перспективами их использования.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Сведения об авторах
Коваленко Дарья Дмитриевна — врач-эндоскопист, аспирант отделения диагностической эндоскопии ГБУЗ МКНЦ им. А.С. Логинова ДЗМ
Быстровская Елена Владимировна — д.м.н., заведующая отделением диагностической эндоскопии ГБУЗ МКНЦ им. А.С. Логинова ДЗМ; e-mail: e.bystrovskaya@mknc.ru
Пронина Галина Михайловна — младший научный сотрудник отделения диагностической эндоскопии ГБУЗ МКНЦ им. А.С. Логинова ДЗМ
Орлова Юлия Николаевна — к.м.н., старший научный сотрудник отделения диагностической эндоскопииГБУЗ МКНЦ им. А.С. Логинова ДЗМ, Москва, Россия; *e-mail: orlovadaria@gmail.com; https://orcid.org/0000-0003-1433-0070
Абдураимов Адхамжон Бахтиерович — д.м.н., заместитель директора по образовательной деятельности ГБУЗ МКНЦ им. А.С. Логинова ДЗМ