staphylococcus haemolyticus 10 5 кое мл что это значит у мужчин норма
Staphylococcus haemolyticus
Добрый день,
2 года назад начались боли в области мочевого пузыря, которые я обнаружил во время пальпации. Ходил по врачам: сдавал бак посев с уретры, бак посев мочи, делал узи простаты. На тот момент УЗИ было в норме, а посев ничего не выявлял.
Спустя 2 года боли стали настолько невыносимы, что не мог спать. Еще раз сделал УЗИ в разных местах, чтобы сформировать независимое мнение (см.вложение). Так же сдал посев в разных местах и после того, как сделали массаж простаты, все-таки выявили бактерию Staphylococcus haemolyticus (см.результаты 1). Назначили лечение 1 (см.лечение 1).
Прошло 30 дней. Сдал анализы повторно (см.результаты 2). Назначили лечение 2 (см. лечение 2).
Вопрос:
1) Во время массажа простаты испытываю болезненные ощущения, так и должно быть или это отклонение от нормы?
2) К антибиотику, которым лечился ранее чувствительность после второго посева не изменилась. Есть вероятность, что действующее вещество просто не доставилось туда куда надо? Как увеличить транспортировку лекарства в отдел простаты? Может лучше попробовать уколы? Ваши советы.
3) Бактерия выявляется только после массажа простаты (в моче ее нет, в уретре тоже), почему так происходит?
4) Нужно ли продолжать лечиться, если болезненные симптомы прошли, но бактерия там осталась, а титр ее увеличился?
5) Прокомментируйте схему лечения №2. Правильно ли подобрана, чем лечить, ваши советы?
На сервисе СпросиВрача доступна консультация уролога онлайн по любой волнующей Вас проблеме. Врачи-эксперты оказывают консультации круглосуточно и бесплатно. Задайте свой вопрос и получите ответ сразу же!
Микрофлора урогенитального тракта у мужчин, обследованных по поводу хронического простатита
Лечение хронической воспалительной патологии урогенитального тракта у мужчин всегда было непростой задачей в урологии. Лечение по поводу этих заболеваний, особенно осложненных нарушением фертильности, сексуальной дисфункцией, синдромом тазовых болей, может быть успешным, если производится индивидуально и базируется на знании этиологии воспалительного процесса, иммунореактивности на данный воспалительный процесс и морфо-функциональные изменений в тазовых органах.
В широкой врачебной практике в настоящее время при диагностике этиологического фактора воспалительной патологии урогенитального тракта акцент делается на выявление инфекций передаваемых половым путем. Целью данного исследования является демонстрация значимости других, не менее важных, этиологических факторов, а также места ИППП в патогенезе данной группы воспалительных заболеваний. Инфекционный воспалительный процесс в урогенитальном тракте возникает по двум механизмам.
В первом случае вирулентная ИППП вызывает клинически и лабораторно идентифицируемый уретрит, который в дальнейшем приводит к возникновению восходящего воспалительного процесса. Патогенетическая роль инфекции передаваемой половым путем в данном случае очевидна: при исследовании отделяемого из уретры, секрета предстательной железы, семенной жидкости выявляется достоверное увеличение количества лейкоцитов и ИППП; первично воспалительный процесс начинается с клиники уретрита. Пациенты с воспалительным процессом такого характера чаще всего находятся на лечении в кожно-венерологических диспансерах, когда помимо острого венерического заболевания имеется клиника простатита.
Второй механизм более сложный. Возникновению инфекционного воспалительного процесса в урогенитальном тракте в данном случае предшествуют определенные предрасполагающие факторы.
Выделим несколько основных групп:
При развитии инфекционного процесса в урогенитальном тракте по данному механизму отсутствует какая-либо клиника уретрита, в исследованиях отделяемого из уретры будет отсутствовать достоверное увеличение количества лейкоцитов, в соскобах из уретры будет значительно реже выявляться ИППП, однако у пациентов будет присутствовать клинически и лабораторно идентифицируемый воспалительный процесс в простато-везикулярном комплексе или в органах мошонки.
При наличии вышеуказанных предрасполагающих факторов инфицирование урогенитального тракта банальной бактериальной микрофлорой принципиально возможно двумя путями: трансуретральным и гематогенным.
Гематогенным путем инфицирование чаще всего происходит из очагов хронической инфекции при сопутствующей ЛОР- патологии, заболеваниях, имеющих широчайшее распространение у населения; при заболеваниях прямой кишки с хроническими запорами, геморрое ( особенно при частых обострениях). Инфицирование по данному пути чаще всего происходит тогда, когда в предстательной железе уже имеются выраженные структурные изменения ( конгестия, кальцинаты, ДГПЖ ).
Более значим трансуретральный путь инфицирования вторичной бактериальной микрофлорой.Следует выделить 4 основных источника бактериального инфицирования.
Таблица микроорганизмов, наиболее часто встречающихся в половых органах у женщин при воспалительных заболеваниях, вызванных влагалищной гарднареллой и неспорообразующими бактериями. ( сборник трудов УрНИИДВиИ, 1985 год )
Виды микроорганизмов.
Морфологические особенности.
Коккобациллы одиночные, парные, полиморфные
Современные подходы к терапии хронического бактериального простатита
Хронический простатит (ХП) принадлежит к числу самых распространенных урологических заболеваний. По данным Н. А. Лопаткина (1998), в России на долю ХП приходится до 35% всех обращений к врачу по поводу
Хронический простатит (ХП) принадлежит к числу самых распространенных урологических заболеваний. По данным Н. А. Лопаткина (1998), в России на долю ХП приходится до 35% всех обращений к врачу по поводу урологических проблем среди мужчин в возрасте от 20 до 50 лет. Для получения данных о частоте встречаемости симптомов простатита с оценкой распространенности дизурии, дискомфорта в промежности и в области полового члена было проведено международное (Англия, Франция, Голландия, Корея) эпидемиологическое исследование Urepik. Анализ, проводившийся на основании шкалы симптомов Nickel и Sorensen (1996), дал возможность выявить признаки простатита у 4800 мужчин в возрасте от 40 до 79 лет. У 35% мужчин за последний год наблюдался как минимум один из симптомов простатита, и для 8% мужчин это представляло, по меньшей мере, неудобство [1].
На долю хронического бактериального простатита (ХБП) приходится 5–15% случаев заболевания [6]. Наиболее распространенными, по мнению большинства исследователей, этиологическими агентами ХБП являются такие грамотрицательные бактерии семейства Enterobacteriaceae, как Escherichia coli, которые обнаруживаются в 65–80% случаев инфекций. Различные виды Serratia, Klebsiella, Enterobacter, Acinetobacter выявляются у 10–15% больных. Большинство исследователей полагают, что на долю таких грамположительных бактерий, как Enterococcus faecalis, приходится от 5 до 10% случаев подтвержденных инфекций простаты [5].
В настоящее время обсуждается роль грамположительных бактерий — коагулазо-негативных стафилококков и стрептококков в развитии ХБП [5, 6, 7]. По нашим данным (Е. Б. Мазо и соавт., 2003, 2004) [1], основанным на результатах микробиологического исследования, которое проводилось в виде четырехстаканного теста Meares–Stamey у 70 больных с ХБП с 2002 г., именно коагулазо-негативные стафилококки играют ведущую роль (66%), если говорить об этиологии ХБП. Между тем на долю грамотрицательных патогенов приходится 19% случаев ХБП, а 15% составляют больные с Enterococcus faecalis. Аналогичными данными располагают М. Ф. Трапезникова и соавторы (2004), суммировавшие результаты идентификации 662 штаммов микроорганизмов у 264 больных ХБП, за которыми велось наблюдение в течение последних 13 лет. При этом выявлена ведущая роль грамположительных кокков в этиологии ХБП: за последние 3 года частота распространения коагулазо-негативных стафилококков составила 87,5% [3]. В то же время удельный вес грамотрицательных палочек — «общепризнанных» возбудителей ХБП — за предыдущие 7 лет неуклонно снижался (с 13,3 до 4,2%). С. Н. Калинина, В. П. Александров, О. Л. Тиктинский (2003) при обследовании 174 больных ХБП также выявили преобладание (82%) грамположительной флоры. Инфекция простаты может быть следствием бактериальной колонизации мочеиспускательного канала. Нормальная флора мочеиспускательного канала у мужчин состоит главным образом из дифтероидов и грамположительных кокков. Сексуальная активность может способствовать колонизации мочеиспускательного канала потенциальными уропатогенами. Blacklock (1974) и Stamey (1980) отметили, что секрет простаты у некоторых мужчин с ХБП содержал те же уропатогены, которые присутствовали в вагинальной флоре их сексуальных партнерш. Бактериальная колонизация может также вызвать персистенцию бактерий в простате. Отличительной чертой этого состояния является персистенция бактерий внутри простаты, несмотря на лечение антибиотиками, что связано с хроническим воспалением и склонностью к обострению инфекции мочевыводящего тракта тем же самым патогеном.
К предрасполагающим факторам развития ХБП относятся: уретропростатический рефлюкс; фимоз; анально-генитальные сношения без предохранения; инфекции мочевых путей; острый эпидидимит; постоянные уретральные катетеры и проведение трансуретральных операций у мужчин с инфицированной мочой без предшествующей антимикробной терапии [1]. У пациентов с ХП может быть выявлено нарушение секреторной функции простаты, характеризующееся изменением состава секрета, т. е. снижением уровней фруктозы, лимонной кислоты, кислой фосфатазы, катионов цинка, магния и кальция; цинксодержащего антибактериального фактора простаты. При этом увеличиваются такие показатели, как рН, отношения изоферментов лактатдегидрогеназы-5 к лактатдегидрогеназе-1, белков воспаления — церулоплазмина и компонента комплемента С3. Эти изменения в секреторной функции простаты также обусловливают неблагоприятное воздействие на антибактериальную природу секрета простаты. Уменьшение действия антибактериального фактора простаты способно снижать врожденную противобактериальную активность секрета, тогда как щелочной показатель рН может препятствовать диффузии в ткань и в секрет простаты основных антимикробных препаратов.
Симптомами ХП являются боли в тазовой области, расстройства мочеиспускания и эякуляции (см. табл. 1).
| Таблица 1 Симптомы хронического простатита | ||
| Локализация боли в тазовой области | Расстройство мочеиспускания | Расстройство эякуляции |
| В промежности В половом члене В яичках В паховой области Над лоном В прямой кишке В крестце | Учащенное мочеиспускание Неполное опорожнение мочевого пузыря Слабая или прерывистая струя мочи Боль или ее усиление во время мочеиспускания | Боли во время или после эякуляции Гемоспермия |
Ведущее место в лабораторной диагностике ХБП принадлежит микробиологическому исследованию — четырехстаканному локализационному тесту, предложенному в 1968 г. Meares и Stamey [8]. Он состоит в получении, после тщательного туалета наружных половых органов (во избежание контаминации поверхностными бактериями), первой (10 мл) и второй (средней) порций мочи для бактериологического исследования, массажа предстательной железы (ПЖ) со взятием секрета для микроскопии и посева, а также третьей порции мочи (после взятия секрета) для посева (рис. 1). Количественные посевы первой и второй порций мочи выявляют бактерии в уретре и мочевом пузыре, в то время как при посевах секрета простаты и порции мочи после взятия секрета (третьей порции мочи) выявляют флору простаты. ХБП характеризуется воспалительной реакцией в секрете (при микроскопии определяется более 10 лейкоцитов в поле зрения при большом увеличении). После инкубации посевов подсчитывают количество колониеобразующих единиц (КОЕ).
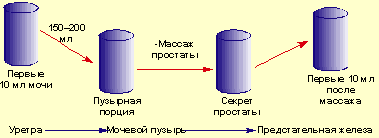 |
| Рисунок 1. Четырехстаканный локализационный тест Meares–Stamey |
Бактериологическое подтверждение ХБП мы проводим на основании, по крайней мере, одного из следующих критериев, предложенных K. G. Naber (2003):
Характерное для ХБП содержание патогенов в образцах примерно следующее:
первая порция мочи 3 КОЕ/мл;
вторая порция мочи 3 КОЕ/мл;
секрет простаты ≥ 10 4 КОЕ/мл;
третья порция мочи ≥ 10 3 КОЕ/мл.
Четкое соблюдение правил микробиологической диагностики и вышеуказанных критериев интерпретации результатов локализационного теста Meares — Stamey на большом количестве наблюдений позволят более точно определить частоту встречаемости истинных патогенов ХБП.
Антимикробная терапия. После идентификации этиологического агента и определения антибиотикорезистентности возникает необходимость назначения больному с ХБП антимикробной терапии. К факторам, оказывающим влияние на выбор антимикробного препарата для лечения ХБП, относятся: чувствительность идентифицированного микроорганизма к антибиотику, его способность в достаточной концентрации проникать через гематопростатический барьер и накапливаться в ткани и секрете простаты, сперме, а также способность препарата преодолевать экстрацеллюлярную полисахаридную оболочку, формируемую микроколониями бактерий, и хорошая переносимость при длительном пероральном приеме. Идеальный антибактериальный препарат для лечения ХБП должен быть жирорастворимым, слабощелочным, с коэффициентом диссоциации, способствующим максимальной концентрации препарата в простате [2]. Антимикробные средства из группы фторхинолонов на сегодняшний день отвечают вышеперечисленным требованиям и являются препаратами выбора для лечения ХБП. Особенностью антибактериального действия фторхинолонов является наличие двух мишеней действия в бактериальной клетке, каковыми являются ферменты (топоизомеразы II типа), ответственные за изменения пространственной конфигурации бактериальной ДНК: ДНК-гираза и топоизомераза IV. ДНК-гираза осуществляет суперспирализацию бактериальной ДНК, а топоизомераза IV — разделение дочерних хромосом в процессе репликации. Ключевым моментом в действии фторхинолонов является образование трехкомпонентного комплекса (бактериальная ДНК–фермент–фторхинолон). Указанный комплекс предотвращает репликацию бактериальной ДНК. Благодаря тому, что топоизомеразы обладают расщепляющей активностью, происходит разрушение молекулы ДНК (С. В. Сидоренко, 2002).
 |
| Рисунок 2. Классификация фторхинолонов (по K.G. Naber,1998) |
В настоящее время в практическое здравоохранение внедрены новые антимикробные препараты из группы фторхинолонов III и IV поколений, которые проявляют активность в отношении как грамотрицательных и грамположительных бактерий, так и атипичных внутриклеточных микроорганизмов, а также обладают способностью воздействовать на бактерии в биологических пленках (см. рис. 2). Антимикробная активность in vitro фторхинолонов III поколения — спарфлоксацина и левофлоксацина, а также фторхинолона IV поколения — моксифлоксацина наглядно представлена в таблице 2.
| Таблица 2 Антимикробная активность in vitro спарфлоксацина, левофлоксацина и моксифлоксацина (МПК90, мкг/мл) [4] | |||
| Микроорганизмы | Спарфлоксацин | Левофлоксацин | Моксифлоксацин |
| Acinetobacter spp. | 0,25 | 16 | 0,5 |
| Citrobacter freundii | 0,25 | 0,5 | 0,5 |
| Enterobacter cloacae | 0,5 | 0,5 | 0,5 |
| Escherichia coli | 0,12 | 0,12 | 0,5 |
| Klebsiella pneumoniae | 0,25 | 0,25 | 0,5 |
| Proteus mirabilis | 0,5 | 0,25 | 0,12 |
| Pseudomonas aeruginosa | 8 | 4 | 16 |
| Staphylococcus epidermidis | 1 | 1 | 2 |
| Staphylococcus saprophyticus | 0,25 | — | 0,5 |
| Enterococcus faecalis | 2 | 16 | 4 |
В 2004 г. мы сравнили чувствительность 25 различных штаммов коагулазо-негативных стафилококков — наиболее распространенных, по нашим данным (Е. Б. Мазо и соавт., 2003, 2004), этиологических агентов ХБП — к левофлоксацину, спарфлоксацину и моксифлоксацину. Бактериологическое исследование проводили классическим методом: выполняли посев мочи и секрета простаты на питательные среды с выделением чистой культуры и идентификацией выделенных штаммов при помощи полуавтоматического микробиологического анализатора Sceptor (Becton Dickinson, USA). Чувствительность выделенных микроорганизмов к левофлоксацину, спарфлоксацину и моксифлоксацину определяли дискодиффузионным методом на среде Мюллера–Хинтона. Результаты оценивали по значениям диаметров зон задержки роста. Всего было изучено 25 штаммов коагулазо-негативных стафилококков (21 — Staphylococcus haemolyticus, 3 — Staphylococcus epidermidis, 1 — Staphylococcus warnerii), выделенных в диагностическом титре из секрета простаты и мочи у больных ХБП при четырехстаканном тесте Meares–Stamey. Проведенный нами анализ чувствительности коагулазо-негативных стафилококков к фторхинолонам III и IV поколений показал наиболее высокую чувствительность этих бактерий к моксифлоксацину — у 24 (96%) штаммов. К левофлоксацину оказались чувствительны 21 (84%), а к спарфлоксацину 20 (80%) штаммов коагулазо-негативных стафилококков. Пять резистентных к спарфлоксацину штаммов были выделены нами у больных после длительной антимикробной терапии этим препаратом. Был выделен также штамм гемолитического стафилококка, резистентный ко всем фторхинолонам III и IV поколений у больного, ранее принимавшего в течение 6 нед моксифлоксацин. Проведенное исследование продемонстрировало высокую чувствительность коагулазо-негативных стафилококков, выделенных от больных ХБП, к фторхинолонам III и IV поколений. Чувствительность исследованных бактерий к моксифлоксацину оказалась наиболее высокой, в то время как к левофлоксацину и спарфлоксацину была практически одинаково ниже. Таким образом, длительная антимикробная терапия моксифлоксацином может привести к селекции устойчивых штаммов и развитию перекрестной резистентности к фторхинолонам III и IV поколений.
На сегодняшний день проведено ограниченное количество клинических исследований применения фторхинолонов в лечении ХБП. Результаты таких исследований, с периодом наблюдения не менее 6 мес, представлены в таблице 3.
Как видно из данных, приведенных в таблице 3, несмотря на существенные различия в количестве больных, принимавших участие в исследованиях, бактериальная эрадикация при различной длительности терапии фторхинолонами, наблюдалась более чем у 60% пациентов. Проведение подобных исследований в будущем, с соблюдением стандартов микробиологической диагностики, позволит выработать единый подход к рациональной антимикробной терапии ХБП.
Согласно актуальным на сегодняшний день рекомендациям Европейской ассоциации урологов по лечению инфекций мочевыводящих путей и инфекций репродуктивной системы у мужчин, принятым в 2001 г., длительность антимикробной терапии ХБП фторхинолонами или триметопримом должна составлять 2 нед (после установления предварительного диагноза). После повторного обследования больного антимикробную терапию рекомендуют продолжать суммарно в течение 4–6 нед только при положительном результате микробиологического исследования секрета простаты, взятого до начала лечения, или в случае, если у больного улучшилось состояние после приема антимикробных препаратов [2].
Антимикробные препараты, используемые для лечения ХБП, а также способы их применения приведены в таблице 4.
| Таблица 4 Способы применения антимикробных препаратов для лечения хронического бактериального простатита | ||
| Группа препаратов | Препараты | Способ применения |
| Фторхинолоны | Ципрофлоксацин (сифлокс, ципролет, цифран) | По 500 мг 2 раза в сутки |
| Офлоксацин (джеофлокс, заноцин, офлоксин 200) | По 400 мг 2 раза в сутки | |
| Ломефлоксацин (ксенаквин, ломфлокс, максаквин) | По 400 мг 1 раз в сутки | |
| Левофлоксацин (таваник) | По 500 мг 1 раз в сутки | |
| Спарфлоксацин (спарфло) | Первый прием 400 мг, затем по 200 мг 1 раз в сутки | |
| Моксифлоксацин (авелокс) | По 400 мг 1 раз в сутки | |
| Триметоприм/ сульфаметоксазол | Ко-тримоксазол (бикотрим, бисептол) | По 960 мг 2 раза в сутки |
Следует отметить, что больные с ХБП должны принимать антибиотик фторхинолонового ряда в течение длительного периода (от 4 до 6 нед) для предотвращения рецидива инфекции нижних мочевых путей. Продолжительная терапия антибиотиками в низких профилактических дозах или супрессивная антимикробная терапия могут применяться в случаях рецидивирующего или невосприимчивого к лечению простатита.
Литература
С. В. Попов
А. К. Чепуров, доктор медицинских наук, профессор
В. И. Карабак, кандидат медицинских наук
РГМУ, Москва
Хронический бактериальный простатит
Опубликовано в журнале: «Врачебное сословие», 2004
Е.Б. Мазо, С.В. Попов
Кафедра урологии и оперативной нефрологии (зав.- член-корр. РАМН, проф. Е.Б.Мазо) РГМУ, Москва
Введение. Хронический простатит является самым распространенным урологическим заболеванием у мужчин моложе 50 лет и третьим по частоте урологическим диагнозом у мужчин старше 50 лет (после доброкачественной гиперплазии и рака простаты), составляя 8% амбулаторных визитов к урологу [4]. С возрастом частота заболевания увеличивается и достигает 30-73% [5]. Влияние этого заболевания на качество жизни сопоставимо с инфарктом миокарда, стенокардией, болезнью Крона, что обуславливает также и значительные психологические и социальные проблемы у больных простатитом мужчин трудоспособного возраста[2].
При определении относительной частоты выявления разных форм хронического простатита большинством специалистов было показано, что на долю хронического бактериального простатита (ХБП) приходится 5-15 % случаев заболевания[6], в то время как на долю воспалительного синдрома хронической тазовой боли приходится 60-65% случаев, а около 30 % составляют больные с невоспалительным синдромом хронической тазовой боли.
Патологическая анатомия. С позиции патологической анатомии, простатит определяется повышением количества воспалительных клеток в паренхиме предстательной железы. Наиболее частым признаком воспаления является лимфоцитарная инфильтрация в строме предстательной железы [7]. Интенсивность воспалительного процесса значительно варьирует от присутствия отдельных лимфоцитов до наличия плотных лимфоидных узелков. Инфильтрация лимфоцитов в строму часто сопровождается воспалением околожелезистой ткани. Пласты или узелки лимфоцитов и отдельных плазматических клеток видны в фиброзно-мышечной строме без видимой связи с протоками и дольками. Гистологические характеристики, связанные с хроническим простатитом, также включают в себя изменение архитектоники желез, фокальное разрушение эпителия, утрату эпителием секреторной активности, а также гиперхромазию и полиморфизм ядер эпителиальных клеток, сопровождающиеся усилением цитоплазматической базофилии.
Представляется спорной роль таких грамположительных бактерий, как Staphylococcus и Streptococcus при ХБП. Некоторые авторы высказывают предположение об этиологической роли таких грамположительных организмов, как Staphylococcus saprophyticus, гемолитических стафилококков, Staphylococcus aureus и других коагулазонегативных стафилококков[9]. Nickel и Costerton (1992) показали, что коагулазонегативные Staphylococcus присутствуют в секрете простаты, а также в образцах ткани простаты, полученных путем трансперинеальной биопсии у мужчин с ХБП (микроскопическое исследование и культивирование). Многие исследователи считают, что эти организмы не являются частой причиной инфекции простаты. Однако, на основании локализационных бактериологических исследований, другие ученые утверждают, что инфекция, вызванная этими бактериями, является обычной причиной симптомов простатита. По очевидной локализации этих организмов в простате, определенной методом количественного культивирования продуктов расщепления мочи и секрета простаты, выдвигалось предположение о роли грамположительных кокков в патогенезе ХБП. Однако, отсутствие связанных с этим бактериурии и цистита ставило под вопрос патогенетический потенциал этих организмов. Этот вопрос, в основном, был разрешен рядом исследований (Fowler, Mariano,1984) по локализации бактерий в образцах мочи и в секрете простаты, у мужчин без симптомов простатита. Эти работы показали, что сам секрет простаты обуславливает высокую степень вероятности инфекции флорой уретры. Такая контаминация может вызывать 10-кратное увеличение количества колоний в секрете простаты по сравнению с образцом первой порции мочи (VB1). Между тем, продолжают выдвигаться предположения, что грамположительные кокки вызывают простатит, по крайней мере, у некоторых пациентов. Например, Nickel и Costerton (1992) определили у нескольких пациентов с хроническим простатитом вовлечение в процесc коагулазо-негативных стафилококков, основываясь на данных по локализации культур, подтвержденных при культивировании организмов из ткани простаты и локализацией стафилококков внутри простаты с помощью электронной микроскопии. Тем не менее, большинство исследователей считают, что грамположительные кокки реже вызывают простатит, чем Enterococcus.
Мы проводили изучение роли грамположительных бактерий в этиологической структуре ХБП. Бактериологическое исследование мочи и секрета предстательной железы выполняли при четырехстаканном тесте по Meares-Stamey 46 больным в возрасте от 20 до 49 лет (средний возраст- 36,9 лет) с хроническим простатитом, у которых методом полимеразной цепной реакции была исключена атипичная внутриклеточная инфекция в секрете предстательной железы.
Грамположительные микроорганизмы выделялись в диагностическом титре с частотой 84,3%, причем среди этих бактерий доминировал Staphylococcus haemolyticus (68,8%) с высокой чувствительностью к ципрофлоксацину- 94% и к тетрациклину-87% при низкой чувствительности бактерий к эритромицину- 54%.
Коринебактерии обычно считались непатогенными организмами для простаты, но существует гипотеза о том, что они являются вероятными этиологическими агентами при ХБП [10]. Domingue с сотр. (1997) предположили, что эти трудно культивируемые формы коринебактерий могут быть утеряны при рутинном культивировании секрета простаты. Непосредственная окраска по Граму секрета простаты определила наличие плеоморфных, различающихся по окрашиванию по Граму коккобацилл, которые обычно не растут на простой среде. Присутствие этих плеоморфных палочек также было показано при окрашивании акридиновым оранжевым. С помощью метода полимеразной цепной реакции Tanner с сотр. (1999) смогли идентифицировать бактериальный сигнал (полигенных грамположительных организмов с преобладанием видов Corynebacterium) у 65% из 17 пациентов с хроническим простатитом. Примерно у половины этих больных были признаки ответа на антимикробную терапию, тогда как их не было у больных, у которых не смогли обнаружить молекулярных сигналов от этих бактерий.
Инфекция простаты может быть следствием бактериальной колонизации мочеиспускательного канала. Нормальная флора мочеиспускательного канала у мужчин состоит, главным образом, из дифтероидов и грамположительных кокков, часто также встречаются микоплазмы и уреаплазмы. Сексуальная активность может способствовать колонизации мочеиспускательного канала потенциальными уропатогенами. Blacklock (1974)и Stamey (1980) отметили, что секрет простаты у некоторых мужчин с ХБП, содержал те же уропатогены, которые были в вагинальной флоре их сексуальных партнеров.
Бактериальная колонизация может также вызвать персистенцию бактерий в простате. Отличительной чертой этого состояния является персистенция бактерий внутри простаты, несмотря на лечение антибиотиками, что связано с хроническим воспалением простаты и склонностью к обострению инфекции мочевыводящего тракта тем же самым патогеном. У большинства больных ХБП не было острого бактериального простатита. Бактериальная колонизация простаты может происходить при колонизации мочеиспускательного канала, применении инструментов, эпизодах асимптоматической бактериурии или во время предшествующей инфекции мочевыводящего тракта.
Было подсчитано, что сейчас определено менее 10% всех бактерий из окружающей нас среды [10], значит, возможно, что “привередливые” и некультивируемые микроорганизмы могут находиться в предстательной железе, и могут быть причиной симптомов. Тщательный обзор данных за и против роли культивируемых, “привередливых”, а также некультивируемых микроорганизмов пока не дает возможности решить этот вопрос.
Дисфункциональное мочеиспускание. Анатомическая или динамическая обструкция, приводящая к появлению повышенного давления и дисфункциональных нарушений потока мочи, имеет особое значение в патогенезе простатита. Blacklock (1991) показал, что анатомические аномалии шейки мочевого пузыря, простаты и уретры определяли предрасположенность некоторых мужчин к развитию простатита. Исследования уродинамики подтверждают, что у многих пациентов, особенно с простатодинией, снижались показатели максимального потока мочи, и наблюдались характеристики потока, демонстрирующие обструкцию (Barbalias, 1983). При видеоуродинамических исследованиях, у многих больных с синдромами простатита видны неполное раскрытие шейки мочевого пузыря, а также признаки детрузорно-сфинктерной диссинергии (Kaplan,1997). Диссинергия при мочеиспускании может привести к анатомически чрезмерной стимуляции нервных волокон, иннервирующей область промежности и таза, с последующим развитием хронического невропатического болевого состояния. Или, такое высокое давление и дисфункциональное мочеиспускание могут вызвать интрапростатический рефлюкс мочи в протоки у части больных.
Уретропростатический рефлюкс. Рефлюкс мочи и, возможно, бактерий в протоки простаты является одним из самых важных механизмов патогенеза хронического бактериального и абактериального воспаления при простатите. По своей анатомии система дренажа протоков периферической зоны более чувствительна к интрапростатическому рефлюксу в протоки, чем другие области простаты (Blacklock, 1974, 1991). Если патогенные бактерии попадают в предстательную железу с помощью рефлюкса, они могут существовать в виде защищенных агрегатов внутри камней простаты. Большое количество культур патогенов, покрывающих камни в простате, было показано Eykyn (1974). Этот способ колонизации бактерий, который заключается в образовании защищающих бактериальных агрегатов или биопленок, связанных с камнями простаты, может приводить к развитию неподдающегося лечению ХБП и к последующей рецидивирующей инфекции мочевых путей, несмотря на, казалось бы, адекватную антимикробную терапию. При помощи трансректальной ультрасонографии Ludwig с соавторами (1994) показали, что у мужчин с ХБП значительно увеличивалась частота образования камней в простате, по сравнению с мужчинами без воспаления простаты (простатодиния). Было показано, что воспаление, вызываемое химической, бактериальной или иммунологической стимуляцией может быть причиной роста интрапростатического давления, измеряемого трансперинеальными датчиками (Mehik и др., 1999).
Иммунологические нарушения. В случае ХБП местная иммунная система простаты активируется при наличии инфекции. При ХБП не выявляется повышения сывороточных иммуноглобулинов, тогда как в секрете простаты уровни обоих IgG и IgA увеличиваются (Kumon, 1992). После успешной антимикробной терапии уровень IgG возвращается к нормальному значению после нескольких месяцев, а уровень IgA (особенно секреторной формы IgA) остается повышенным еще почти 2 года (Fowler и Mariano, 1984a). Бактерии, покрытые антителами, которые определяются в моче, секрете простаты и сперме, являются другим заметным признаком ХБП.
При абактериальном простатите бактериальное воспаление простаты может быть вторичным иммунологически опосредованным воспалением, вызванным каким-нибудь неизвестным антигеном, или, возможно, воспаление может быть связанно с аутоиммунным процессом. Уровни антител IgA и IgM (неспецифичных к микроорганизмам) повышаются (Shortliffe и др., 1992), подобные антитела, так же как фибриноген и С3 компонент комплемента (Doble и др., 1990) были обнаружены при биопсии простаты у больных с хроническим простатитом. Каким бы ни было начальное событие, оказывается, что иммунологический каскад играет важную роль при развитии простатита (Moon, 1998; Kumon, 1999).
Химическое асептическое воспаление. Исследователи установили, что моча и продукты ее обмена (например, ураты) присутствуют в секрете простаты у больных с хроническим простатитом (Persson и Ronquist, 1996). Эти исследователи выдвинули гипотезу, что воспаление простаты и последующие симптомы являются вторичными, и могут возникать просто благодаря воспалению, вызванному ядовитыми химическими веществами, которые содержатся в моче, и которые попали в проток простаты при рефлюксе.
Нейрогенные расстройства. Некоторые исследователи [12] предполагают, что нарушения чувствительности или моторики, или и то, и другое вместе, согласующееся с нейрогенной дисрегуляцией нижних мочевых путей, могут быть следствием приобретенных нарушений со стороны центральной нервной системы. Zermann и Schmidt (1999) описали 103 пациента с хронической тазовой болью, которых они оценивали по специальной неврологической шкале. Они показали, что большинство мужчин не имели полного сознательного контроля над мышцами тазового дна, соматическая иннервация которых осуществляется полосатым телом. У пациентов были различные уровни определения своих мышц тазового дна, но никто не смог продемонстрировать полное сокращение и расслабление мышц тазового дна с повторением и без напряжения. Это проявлялось и в том случае, если были признаки воспаления, и если их не было. Ученые заключают, что эти данные отражают функциональное разобщение ЦНС с периферической мишенью – мышцами тазового дна.
Расстройства мышц тазового дна. Некоторые клиницисты полагают (Anderson, 1999), что источник боли находится именно в области прикрепления мышц таза к крестцу, копчику, седалищному бугру, лобковым костям и глубокой тазовой фасции. Эти области непосредственно соприкасаются с простатой и мочевым пузырем, и могут выявляться при определении зоны гиперчувствительности или миофасциальной триггерной точки, где возникает боль при сдавлении. Выдвинута гипотеза об образовании миофасциальных триггерных точек в тазовой области как следствие механических повреждений бедра и нижних конечностей; сексуальных эксцессов, травмы и запоров и хирургических вмешательств.
Cогласно последним представлениям одной из причин большинства болевых синдромов являются функциональные расстройства, приводящие к различным органическим нарушениям. Мы предполагаем, что дисфункция мышц тазового дна вследствие нарушения их периферической иннервации приводит к развитию синдрома хронической тазовой боли, химическому асептическому воспалению вследствие уретропростатического рефлюкса, с последующим бактериальным инфицированием простаты.
Вероятно хронический простатит является полиэтиологическим заболеванием с многофакторным набором патогенетических механизмов. Ряд ученых рассматривает это заболевание в качестве каскада событий после действия определенных пусковых факторов. Рисунок 1 демонстрирует предложенный урологической клиникой РГМУ гипотетический сценарий взаимосвязанных между собой предрасполагающих факторов и патогенетических механизмов хронического простатита
Рис 1. Взаимосвязь предрасполагающих факторов и патогенетических механизмов при хроническом простатите.
