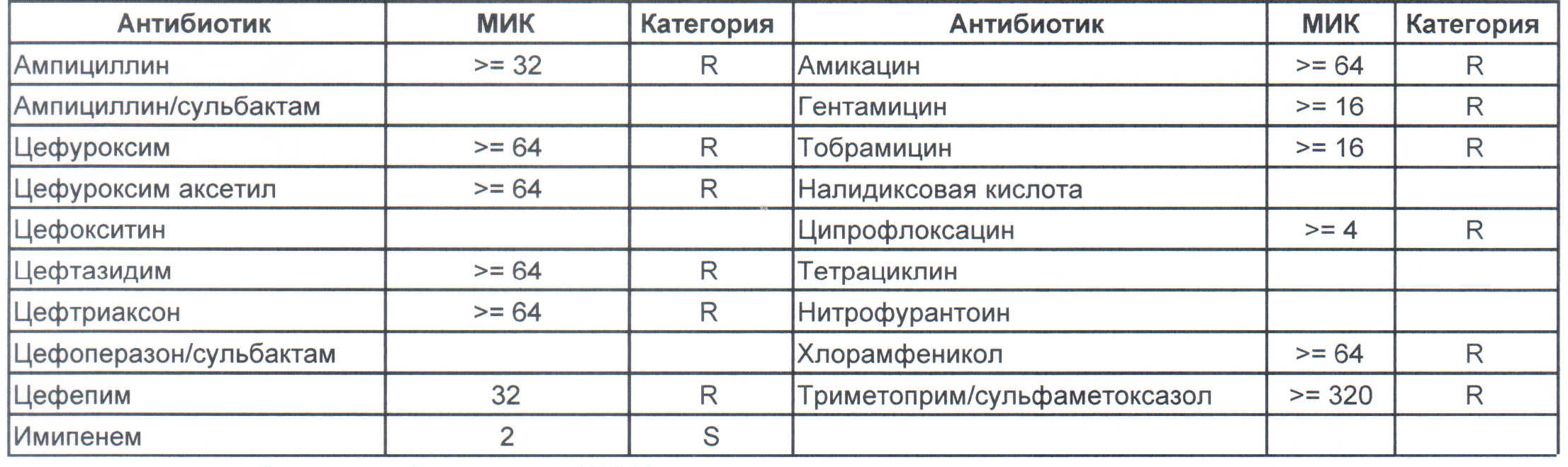
k pneumoniae что это такое и чем лечить
Klebsiella pneumoniae (клебсиелла пневмонии)

Klebsiella pneumoniae в ЖКТ человека
Klebsiella pneumoniae колонизирует кишечник современного человека в первые 5–6 дней жизни, причем основным источником Klebsiella pneumoniae являются мать и персонал родильных домов. Обнаружение Klebsiella pneumoniae в желудочно-кишечном тракте (ЖКТ) человека, в общем случае, не требует лечения. У здорового человека в 1 г кала насчитывается до 10 5 Klebsiella pneumoniae.
Причиной клебсиеллеза органов ЖКТ может быть дисбактериоз или заражение от больных инфекционной формой клебсиеллеза. Болезнь проявляется в форме острого гастрита, гастродуоденита, кишечной инфекции и характеризуется острым началом, тошнотой, рвотой, болями в животе, поносом, повышением температуры и общей слабостью. Продолжительность клебсиеллеза органов ЖКТ — 1–5 дней.
Klebsiella pneumoniae — причина внутрибольничных инфекций
Klebsiella pneumoniae и инфекции мочевыводящих путей и половой сферы
Klebsiella pneumoniae — один из распространенных возбудителей инфекционных заболеваний мочевыводящих путей. В отличие от ЖКТ или кожи, для мочевыводящих путей Klebsiella pneumoniae всегда является патогенным микроорганизмом. Среди обращающихся за амбулаторной помощью пациентов с неосложненными инфекционными заболеваниями мочевыводящих путей причиной инфекции в 6,4 % случаев является Klebsiella pneumoniae. Для пациентов с осложненными инфекционными заболеваниями мочевыводящих путей эта цифра достигает 9,4 %. Klebsiella pneumoniae в мочеполовых путях часто является следствием внутрибольничных инфекций.
Клебсиелла пневмонии может встречаться во влагалищной микрофлоре, в частности, после приёма антибиотиков, результатом которого было уничтожение нормальной микрофлоры влагалища. Клебсиелла пневмонии в мочеполовых путях часто является следствием внутрибольничных инфекций.
Клебсиелла риносклеромы
Клебсиелла озены
Лечение клебсиеллезов
Для лечения клебсиеллезов обычно применяются антибиотики. Также используются лекарственные препараты, действующим веществом которого являются бактериофаги (Бактериофаг клебсиелл пневмонии очищенный жидкий, Секстафаг и др.). Бактериофаги действуют избирательно, не имеют противопоказаний, но они менее эффективны, чем антибиотики.
Антибактериальные средства, активные в отношении Klebsiella pneumoniae (из имеющих описание в данном справочнике): левофлоксацин, норфлоксацин, офлаксацин, а также гентамицин, нафтифин и другие.
Klebsiella pneumoniae устойчива к клотримазолу.
Klebsiella pneumoniae в систематике бактерий
Вид Klebsiella pneumoniae входит в род клебсиелла (лат. Klebsiella), семейство энтеробактерии (лат. Enterobacteriaceae), порядок энтеробактерии (лат. Enterobacteriales), класс гамма-протеобактерии (лат. γ proteobacteria), тип протеобактерии (лат. Proteobacteria), царство бактерии.
Устаревшее название Klebsiella pneumoniae — палочка Фридлендера. Карл Фридлендер (нем. Carl Friedländer, 1847–1887) — немецкий микробиолог, выделивший чистую культуру Klebsiella pneumoniae в 1882 году.
Первоначально Klebsiella pneumoniae была определена, как микроорганизм вызывающий пневмонию (отсюда и ее название). Однако её роль не сводится только к инфекциям респираторной системы. В общем случае Klebsiella pneumoniae классифицируется как условно-патогенный микроб, находящийся в нормальной ситуации и в определенных органах в симбиотическом отношении с человеческим организмом, а в иных ситуациях являющийся причиной инфекционных заболеваний.
Клебсиелла
Темой нынешнего разговора будет, с точки зрения автора, королева внутрибольничных инфекций любого стационара — Klebsiella pneumonia (или палочка Фридлендера).
Автор: Трубачева Е.С., врач – клинический фармаколог
Темой нынешнего разговора будет, с точки зрения автора, королева внутрибольничных инфекций любого стационара — Klebsiella pneumoniae (или палочка Фридлендера). Да-да, автор не ошибся, именно она, а не синегнойки или ацинетки, а именно ее величество — клебсиелла, практически абсолютная убийца тяжелых и крайне тяжелых пациентов. Почему это именно так, мы сегодня и поговорим.
Микробиологические аспекты
Первое и главное, о чем надо знать, — Klebsiella pneumonia — это представитель нормальной микрофлоры кишечника. Еще раз и большими буквами — НОРМАЛЬНОЙ! Не надо ее там лечить (как и стафилококк в носоглотке) — она там живет, и это ее естественный ареал обитания.
А все остальные локации, где она может быть обнаружена: нижние дыхательные пути, мочевыводящий тракт, секрет простаты или содержимое полости матки (анальный сексуальный акт без презерватива — зло, имейте это в виду при сборе анамнеза, особенно у женщин с послеродовым эндометритом, автор такого навидался в достатке… мужчин это тоже касается, и обнаружение подобной зверюшки в секрете простаты должно навести на определенные мысли и вопросы, и пока пациент не закончит данную практику, простатит вы ему при всем желании не вылечите), кровь и в раны при раневых инфекциях после хирургического вмешательства на брюшной полости — могут указывать на возбудителя текущего состояния.
Что вызывает:
Общим у всех этих патологий является одно — они все тем или иным образом связаны с вмешательством, и чаще всего (опуская уже упомянутые анальные сексуальные акты) это вмешательство носит ятрогенный характер. Клебсиелла не умеет ни летать, ни ходить, ни даже ползать, в очаг ее приносят либо неправильно вымытые руки, либо плохо обработанное медицинское оборудование.
Эпидемиологические аспекты
Как мы уже обсуждали в статье о синегнойной палочке, при некотором желании и упертости эпидемиологической службы или клинического фармаколога (или команды из оных, так как каждый знает свое звено), извести неферментеров из стационара — не самая сложная задача. Было бы желание у администрации этим заняться. Что касается лечащих врачей и среднего персонала, то это тот случай, когда достаточно обработать перчатки и далее, на уровне ЦСО и утилизации отходов, правильно избавиться от контаминированого материала, и если инструментарий не одноразовый, то очистить и простерилизовать его. То есть даже на уровне обработанных (или стерильных) перчаток, касающихся только одной области пациента (другая область, если необходимо, требует смены перчаток, либо обработки рук с полным выдерживанием экспозиции, а не чуть-чуть антисептиком помазал-растер-побежал), вы уже снижаете риск контаминации оным зверьем с последующим развитием синегнойной инфекции. Про ацинетобактер будет отдельная глава в разделе «неферментеры».
С клебсиеллой все намного сложнее. Эта, не побоюсь громкого слова, зверища, живет в кишечниках всего персонала медицинских учреждений. И в первую очередь, как понятно из ее названия, поражает нижние дыхательные пути. А если персонал работает с антибиотиками, то клебсиелла еще и устойчивая ко всему арсеналу применяемых препаратов (это к вопросу о разумном ограничении доступа к препаратам резерва). Так как сама клебсиелла не имеет ножек и крылышек, то попадает в оные пути она двумя способами: или в случае аспирации, или на руках персонала и с оборудования. Иного не дано. При аспирации это будет личная дикая зверюшка пациента, в случае грязных шаловливых ручек или оборудования (например, эндоскопов) — клебсиелла, высеваемая в отделении в процессе микробиологического мониторинга. А если этот мониторинг углубленный, то напрямую покажет, какая именно хрюшка, выйдя из туалетной комнаты, не соизволила помыть руки, понадеявшись на перчатки. И нет, перчатки, даже стерильные в данном случае, не спасают, они не презерватив. Руки надо мыть и обрабатывать правильно, обязательно соблюдая технологию и экспозицию.
Как вы понимаете, истребить медицинский персонал мы не можем, поэтому и полностью очистить стационар от данной проблемы не получится. И она обязательно выскочит, стоит на секунду расслабиться, и выскочит на самом тяжелом больном, где еще умудрится смутировать в такого урода, которого не достанешь никаким антибиотиком.
На общемировом клебсиеллу тоже очень сильно боятся, и когда в 2010 году вдруг в Великобритании обнаружили штамм NDM (он устойчив вообще ко всему набору существующих антибиотиков и обозван абсолютным убийцей), паника была знатной. В результате проведенного эпидемиологического расследования, по итогам которого большая группа видных ученых стала персонами non-grata в Индии, было установлено, что данный штамм привезен оттуда и из Пакистана. Присутствие в сточных водах возбудителей, имеющих карбапенемазы (то есть это уже не внутрибольничная флора, это то, что там живет на улице) на момент проведения расследования составляла 90% по CTX-M15 и 36% по NDM. С чем связан сей факт? С безрецептурным масштабным использованием карбапенемов и… проблемами с проточной канализацией. Ее либо нет, либо ей не пользуются, а делают все по старинке. А так как земной шар оказался очень маленьким, теперь NDM-штаммы обнаруживаются по всей планете. У нас, например, очень быстро данным штаммом заселились клиники Санкт-Петербурга. И медицина перед ними бессильна. До тех пор, пока не налажен эпиднадзор, а персонал не моет руки после каждого посещения туалета.
Так как любого врага надо знать в лицо, то наиболее часто встречаемые портреты у автора тоже есть.
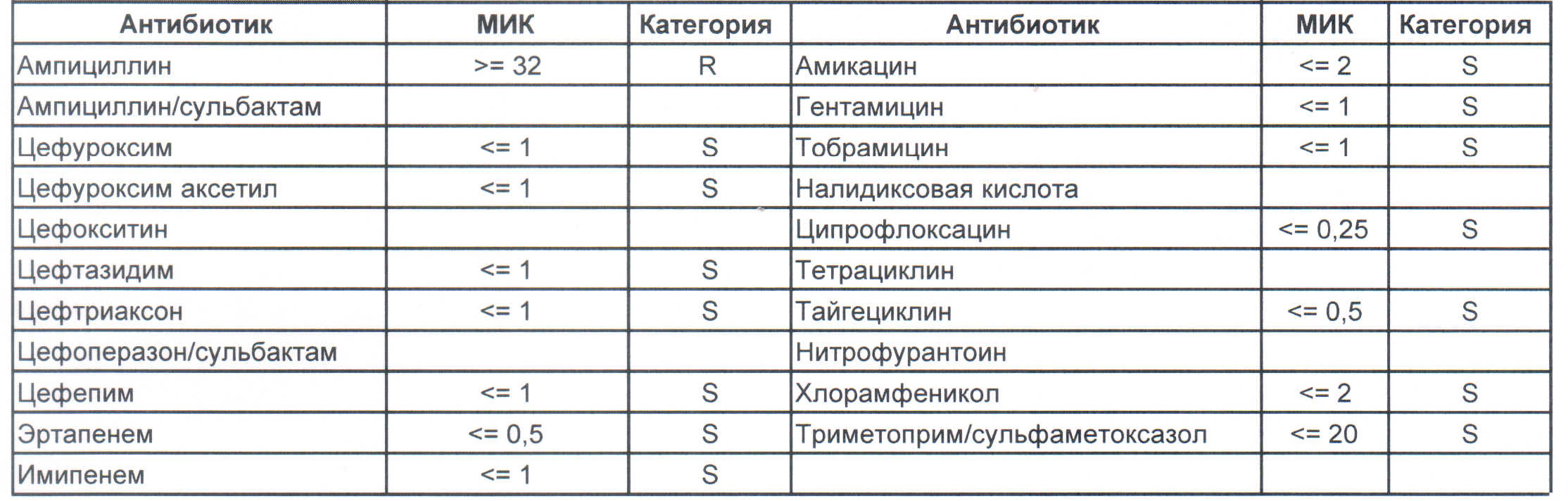
Итак, дикая и ничем ни разу не пуганная клебсиелла выглядит вот так:
Где встречается? Те самые послеродовые эндометриты, как результат плотских утех, простатиты, а также раневые инфекции после оперативных вмешательств на брюшной полости у ранее не леченных пациентов.
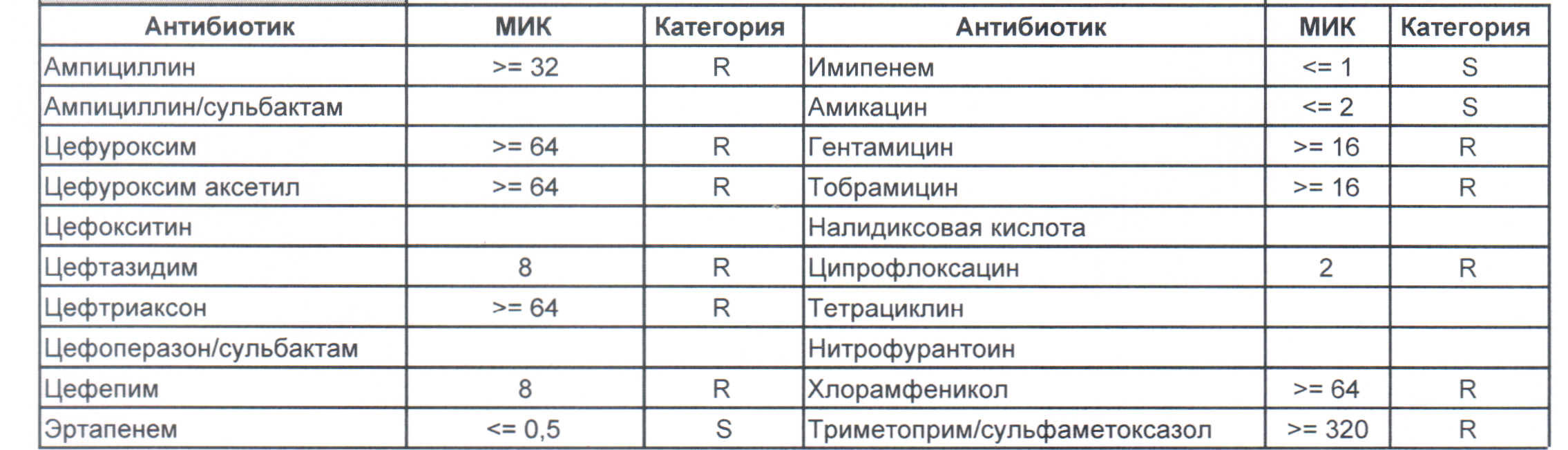
— вы можете увидеть устойчивый внутрибольничный штамм, который еще можно чем-то полечить, но это будет тяжело и дорого, проще персонал научить руки мыть и бороды брить (фекальной микрофлоры в мужских бородах в таком достатке, что единственный вариант для тех, кто хоть как-то соприкасается с ранами, данное украшение не носить или не оперировать).
На следующей картинке:
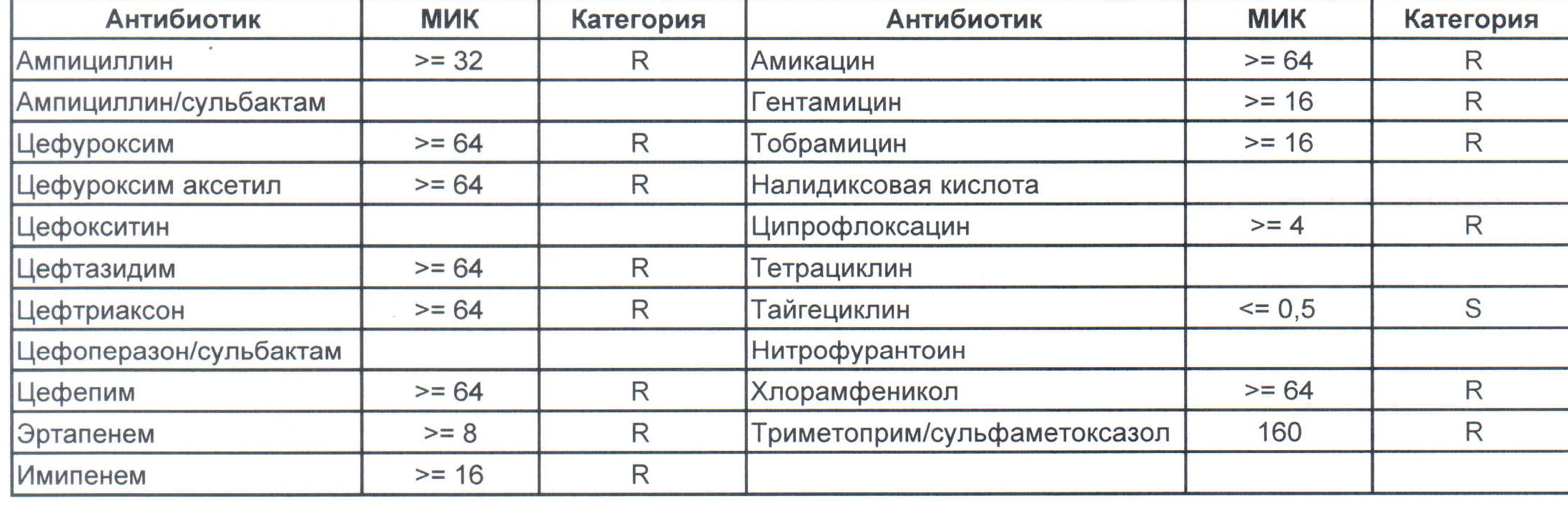
— мы видим практически неубиваемого зверя, который сам по себе вбивает тот самый последний гвоздь в гроб пациента. Но как же Тигециклин, спросите вы. Отвечу — тигацил является бактериостатиком, и пока он наберет необходимую силу, пациента уже отнесут и закопают. Но даже это еще не предел. Предел на следующем рисунке, и нет, Имипенем при указанной MIC уже бессилен:
Как вы понимаете — эти два зверя являются абсолютными убийцами, против которых в данный момент медицина бессильна полностью. И именно такое зверье живет в стационарах без микробиологического мониторинга и систем противостояния в виде эпидемического надзора. Именно эти звери убивают самых тяжелых пациентов, если каким-то образом (руки персонала или плохо обработанное оборудование) в них попали. Но что хуже всего, эти штаммы способны передавать свои факторы устойчивости другой грамотрицательной флоре, например, кишечным палочкам, а потому пациенты, инфицированные такими клебсиеллами, должны быть полностью изолированы и карантинизированы. Спасти их, скорее всего, не получится, но хотя бы всех остальных оградите от инфицирования и последующего летального исхода, да и сами такую зверюшку не подцепите (как вы помните «врач — это диагноз», так не будем его себе усложнять).
Чем лечить?
Дикая клебсиелла отлично лечится препаратами группы цефалоспоринов третьего ряда.
А вот внутрибольничную можно побороть, только четко понимая, с чем вы имеете дело, и обычный диско-дифузионный метод диагностики тут не поможет. Нужны автоматизированные системы с определением MIC. Но во главе угла все равно стоит инфекционная безопасность пациентов. Коллеги! Автор понимает, что выглядит «городской сумасшедшей», коим в свое время был объявлен Земмельвейс, но он вас умоляет — мойте руки после посещения туалета и мойте их правильно. Вам это ничего не стоит, а пациенты выживут. Ничего более эффективного против внутрибольничных клебсиелл пока не придумано. А эпидемиологи ваших учреждений будут проводить свои работы по контролю и дезинфекции отделений и целых зданий. Так получилось, что именно эту королеву ВБИ мы, врачи, медсестры и младший персонал, носим исключительно в себе. Берегите себя, своих близких и своих пациентов, тем более в это нелегкое для отечественной медицины время, с угрозой введения врачебных статей в УК. Клебсиелла — это почти всегда чистая ятрогения. Повторюсь — берегите себя и мойте руки.
Симптомы клебсиеллёзов
В летний период становятся актуальны заболевания вызванные инфекционными агентами.
Особенно активны микроорганизмы семейства энтеробактерий – грамотрицательные, палочкообразные, с жгутиками для передвижения и прикрепления, факультативные анаэробы: кишечная палочка, сальмонелла, клебсиелла и др. Так, клебсиелла – klebsiella, может существовать в почве, воде, месяцами оставаясь жизнеспособной, сохраняется на пище и пыли.
Клебсиеллы могут попасть в организм через желудочно-кишечный тракт, с плохо вымытых рук, овощей и фруктов, с водой, с почвой. Однако, этот микроорганизм входит в группу условно-патогенной микрофлоры и определяется у абсолютно здоровых детей и взрослых, считается одним из элементов нормальной флоры кишечника.
При этом, клебсиелла является одной из самых распространённых внутрибольничных инфекций, т.к. она устойчива к действию факторов окружающей среды, высоким температурам. Хотя, за несколько минут она гибнет от дезинфектантов, а при очень высоких температурах через 1-1,5 часа. При несоблюдении надлежащих правил гигиены, санитарных норм в помещениях, встречаются случаи заражения новорожденных клебсиеллой в роддомах. Малыш постоянно плачет и не может заснуть, его беспокоят колики и частый понос. А причина — клебсиелла – бактерия, устойчивая к губительному действию внешней среды, покрытая плотной капсулой.
Факторы развития клебсиеллеза
Клебсиеллы относятся к одному семейству с бактериями рода Serratia и Enterobacter. Этими возбудителями, особенно Serratia, обладающий наибольшей лекарственной устойчивостью, обусловливаются вспышки инфекции в стационарах, в связи с загрязнением ряда медикаментозных средств, лекарственных растворов, применяемых в терапии органов дыхания. Их трудно, но можно дифференцировать только с помощью специальных проб. Klebsiella Enterobacter и Serratia, вызывающие внутрибольничную пневмонию, инфекцию мочевого тракта, бактериемию, обладают различной чувствительностью к противомикробным препаратам.

Если защита организма человека по какой то причине ослаблена: снижен общий иммунитет, часто грипп, ОРВИ, применение антибиотиков, употребление загрязненных, некачественных продуктов, сахарный диабет, алкоголизм и др., клебсиелла начинает активно размножаться, выделять токсины, вызывая эндотоксимию и воспалительные процессы в разных органах. Развиваются такие заболевания, как воспаление легких, воспалительные заболевания мочевыводящих путей, менингит, конъюнктивит, кишечные инфекции, сепсис и достаточно редкие болезни – озена (зловонный насморк), риносклерома.
Наиболее часто клебсиелла вызывает пневмонию и поражение кишечника. У взрослых людей чаще встречается пневмония, вызванная палочкой Фридлендера. В связи с особенностью иммунитета новорожденных и недостаточностью у них нормальной микрофлоры на коже, в дыхательных путях и особенно в кишечнике — клебсиелла — Klebsiella oxytoca — чаще вызывает поражения желудочно-кишечного тракта — толстого кишечника.
Симптомы клебсиеллы (клебсиеллёза) в ЖКТ у грудничков
Симптомы клебсиеллы у малышей схожи с симптомами дисбактериоза: вздутие, метеоризм, колики, срыгивание. Но чаще проявляются — жидким стулом со слизью, кровью и резким запахом, повышением температуры, лихорадкой, болями в животе и сильным обезвоживанием организма. В зависимости от того, какой иммунитет у малыша, течение заболевания может протекать как в лёгкой форме, так и грозить тяжелыми инфекционными осложнениями. Если клебсиелла в организме быстро размножается, выделяет токсины, нарастает интоксикация, обезвоживание, то заболевание может проявиться в течение нескольких часов и потребует срочной госпитализации ребенка.
Поэтому, при любом расстройстве стула, необходимо обратиться к врачу, сдать кал ребёнка на анализ, пройти обследование, чтобы точно выявить, какие именно бактерии вызвали изменение состояния ребёнка. Большую роль в восстановлении иммунитета и нормальной микрофлоры у новорожденного играет грудное вскармливание. При высокой обсеменённости клебсиеллой и тяжёлой форме заболевания, лечении ребенка в больнице, назначают сложную терапию с применением антибиотиков. Если заболевание грудничка протекает в лёгкой форме, то для коррекции микрофлоры кишечника назначают пробиотики. Синбиотики – Нормофлорины Л и Б – обладают активным противовоспалительным, антисептическим и питательным действием, что важно при клебсиеллёзной инфекции. Ребенок может чувствовать себя нормально, а при обследовании находят в анализах повышение количества клебсиелл. Тогда препараты с лакто- и бифидобактериями назначают для вытеснения излишнего количества клебсиеллы, повышения иммунитета, улучшения собственной полезной микрофлоры.
Симптомы клебсиеллы в других органах и системах
Если клебсиеллы попадают в мочевыделительную систему, то они способны вызывать уретрит, пиелонефрит, со стойким рецидивирующим течением, плохо поддающимся терапии и часто измененной чувствительностью к антибиотикам. В редких случаях клебсиеллёза, возможно такое осложнение, как – озена — зловонный насморк, с поражением слизистой носа, образованием гнойных, болезненных, кровоточащих корок.
Симптомы и признаки инфекций мочевыводящих путей, желчного пузыря и в брюшной полости, вызываемых клебсиеллами, не отличаются от симптоматики, обусловленной кишечной палочкой. Развиваются они чаще у больных сахарным диабетом и у пациентов, получающих антимикробные препараты, к которым устойчив возбудитель заболевания. Клебсиелла является также важным этиологическим фактором септического шока.
Клебсиелла известна как фактор развития легочных заболеваний, однако, среди причин, вызывающих бактериальную пневмонию, имеет около 1% всех случаев. Встречается преимущественно у мужчин в возрасте старше 40 лет, с хроническими бронхолегочными заболеваниями, больных сахарным диабетом и лиц с алкоголизмом. У пожилых людей, грамотрицательные бактерии заселяют ротоглотку и могут распространиться по дыхательному тракту, вызывая пневмонию или гнойный бронхит.
Клинические симптомы клебсиеллёзной пневмонии сходны с проявлениями при пневмококковой пневмонии, но чаще характеризуются более тяжелым течением: внезапным началом, ознобов, стойким повышением температуры тела, продуктивным кашлем, иногда с прожилками крови и резким запахом, с сильными плевральными болями, появлением одышки. Больные часто находятся в прострации и бредовом состоянии, за счет интоксикации. Чаще всего очаг воспаления располагается в правой верхней доле легкого, но может быстро прогрессировать, если лечение не проводится и распространиться с одной доли на другую. Появляются цианоз и одышка, могут возникнуть желтуха, рвота, диарея. Выявляется, при обследовании, образование плеврального выпота, уплотнение легочной ткани, или некротизирующая пневмония, с быстрой кавернизацией. На фоне интоксикации определяется снижение количества лейкоцитов в периферической крови, а не повышение, как при воспалении. Гораздо чаще наблюдаются абсцессы и эмпиемы легких. Это объясняется способностью клебсиелл вызывать деструкцию ткани. Не всегда выявляются характерные признаки при рентгеновском обследовании: уменьшение объема легкого, его уплотнение, эмфизематозные изменения. При медленном прогрессировании инфекционного воспалительного процесса может развиться хронический некротизирующий пневмонит, напоминающий туберкулез, с продуктивным кашлем, слабостью, выраженной анемией.
Лечение клебсиеллезов
Лечение заболеваний, вызванных клебсиеллой, зависит от локализации и выраженности патологического процесса. Антибиотики назначают в тяжелых случаях по чувствительности, при легком течении или только обнаружении в анализах повышения клебсиелл — не применяют. Обязательно используют разнообразные препараты, восстанавливающие кишечную микрофлору.
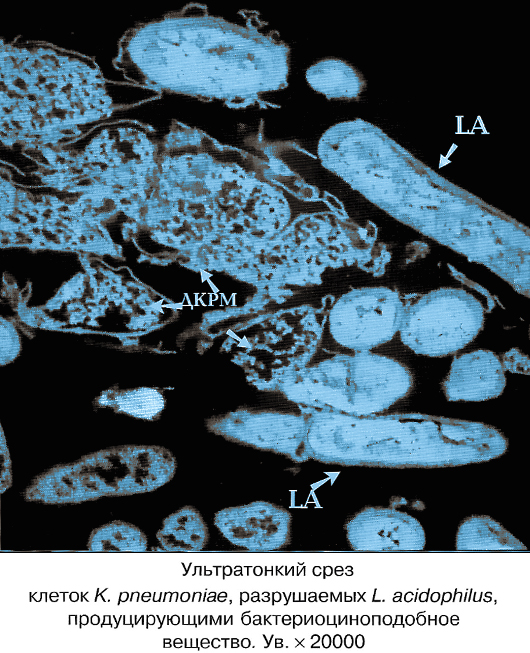
Как правило, антимикробную терапию рекомендуют начинать еще до получения результатов посева и определения лекарственной чувствительности к антибиотикам. В этом случае биокомплексы Нормофлорины, содержащие продукты жизнедеятельности живых лакто- и бифидобактерий с активным антисептическим, противовоспалительным действием, оказывают лечебный эффект при клебсиеллёзах, что доказано научными исследованиями и многолетней практикой, как у новорожденных, беременных, кормящих, так и взрослых и пожилых.
Диагностика и лечение микоплазменной и хламидийной пневмоний
Cреди всех видов пневмоний практическому врачу наиболее часто приходится сталкиваться с внебольничной пневмонией. По данным официальной статистики МЗ РФ, заболеваемость внебольничной пневмонией в России среди лиц старше 18 лет составляет
Cреди всех видов пневмоний практическому врачу наиболее часто приходится сталкиваться с внебольничной пневмонией. По данным официальной статистики МЗ РФ, заболеваемость внебольничной пневмонией в России среди лиц старше 18 лет составляет 3,9%. Зарубежные исследователи установили, что заболеваемость внебольничной пневмонией среди лиц молодого и среднего возраста варьирует от 1 до 11,6%, а в старшей возрастной группе достигает 25–44% [11, 13].
Наиболее распространенной причиной внебольничных пневмоний является Streptococcus pneumoniae (30–50%) [5, 11, 13]. Однако все большее значение среди этиологических факторов внебольничной пневмонии в последние годы придается так называемым атипичным микроорганизмам, прежде всего Mycoplasma pneumoniae и Chlamydophila (Chlamidia) pneumoniae, на долю которых приходится от 8 до 25% случаев заболевания [5, 9, 12].
Mycoplasma pneumoniae в структуре внебольничных пневмоний варьирует в пределах 5–50% [7, 11, 13]. Наиболее часто микоплазменная пневмония диагностируется у детей старше 5 лет и лиц молодого возраста (до 25 лет) [3, 4, 7, 10]. Каждые 3–5 лет наблюдаются эпидемиологические подъемы заболеваемости, которые длятся несколько месяцев. Вспышки заболевания характерны для изолированных и полуизолированных групп населения (военнослужащие, студенты, школьники и др., семейные вспышки) [10, 11]. Признается наличие сезонных колебаний, а именно большая распространенность инфекции в осенне-зимний период [6, 10, 13]. Источником инфекции являются как больные, так и носители. Механизм передачи инфекции — аэрогенный, путь передачи — воздушно-капельный. Инкубационный период длится 2–3 нед. Летальность при микоплазменной пневмонии составляет 1,4% [4, 11].
Mycoplasma pneumoniae занимает промежуточное положение между вирусами, бактериями и простейшими и является мембрано-ассоциированным (но может быть и внутриклеточным) анаэробом, имеет трехслойную цитоплазматическую мембрану вместо клеточной стенки, что обусловливает резистентность к различным агентам, подавляющим синтез клеточной стенки, прежде всего к пенициллину и другим β-лактамам [6, 10]. С помощью терминальной структуры микоплазма прикрепляется к клеткам хозяина (эритроцитам, клеткам реснитчатого эпителия бронхов и др.) [6]. Микоплазма также обладает механизмом мимикрии под антигенный состав клетки-хозяина, что способствует длительной персистенции возбудителя и вызывает образование аутоантител и развитие аутоиммунных процессов при микоплазменной инфекции [6, 10]. Предполагается, что именно с формированием аутоантител связано развитие нереспираторных проявлений Mycoplasma pneumoniae-инфекции.
Считается, что от 5 до 15% внебольничных пневмоний вызываются хламидиями, а в период эпидемии эти показатели могут увеличиваться до 25% [4, 5, 10]. Наиболее часто хламидийная пневмония встречается у взрослых, особенно у лиц среднего и пожилого возраста [2, 10]. Описаны эпидемиологические вспышки в изолированных и полуизолированных коллективах, случаи внутрисемейной передачи хламидийной инфекции [7, 10, 13]. Сезонной закономерности распространения этой инфекции не выявлено. Единственным известным резервуаром инфекции является человек. Механизм передачи — аэрогенный, путь передачи — воздушно-капельный. Инкубационный период составляет 2–4 нед. Летальность при хламидийных пневмониях достигает 9,8% [4, 5, 13].
Chlamydophila pneumoniae — это патогенные облигатные внутриклеточные грамотрицательные бактерии, способные к латентному существованию или персистенции в организме хозяина. Характеризуются двухфазным циклом развития, состоящим из чередования функционально и морфологически различных форм — элементарных и ретикулярных телец [2, 4, 7, 10].
Клинические проявления микоплазменнойи хламидийной пневмоний
У 30–40% пациентов, заболевших микоплазменной и/или хламидийной пневмонией, диагноз ставится лишь в конце первой недели болезни; первоначально у них чаще всего ошибочно диагностируются бронхит, трахеит или ОРЗ. Это связано с тем, что, в отличие от бактериальных пневмоний, микоплазменная и хламидийная не имеют отчетливых физикальных и рентгенологических признаков инфильтрации, а культуральная диагностика их невозможна, так как микоплазмы и хламидии являются внутриклеточными возбудителями. Поэтому диагностика микоплазменной и хламидийной пневмоний основывается в первую очередь на выявлении особенностей клинико-рентгенологических данных и подтверждается серологически или с помощью полимеразно-цепной реакции (ПЦР).
Обычно микоплазменная и хламидийная пневмонии начинаются с респираторного синдрома, проявляющегося трахеобронхитом, назофарингитом, ларингитом; протекают с субфебрильной температурой, малопродуктивным, мучительным кашлем, скудными аускультативными данными; характеризуются наличием внелегочных проявлений — кожных, суставных, гематологических, гастроэнтерологических, неврологических и других, а также нетипичными лабораторными показателями — отсутствием лейкоцитоза и нейтрофильного сдвига в периферической крови [3, 4, 7, 10, 11]. Рентгенологические изменения в легких отмечаются усилением легочного рисунка, перибронхиальной или субсегментарной инфильтрацией [5, 10, 11, 13].
Нами были обследованы 60 пациентов: 44 — с микоплазменной пневмонией и 16 — с хламидийной пневмонией. Анализ клинического материала показал, что начало заболевания при микоплазменной и хламидийной пневмониях может быть как острым, так и постепенным (табл. 1). При подостром течении пневмония начинается с поражения верхних дыхательных путей, ухудшения общего состояния и познабливания. Температура тела может быть нормальной или субфебрильной в течение 6–10 дней и лишь потом повышается до 38–39,9°С при микоплазменной и до 38–38,9°С при хламидийной пневмонии. При остром начале симптомы интоксикации появляются уже в первый день и достигают максимума к 3-му дню болезни. У пациентов с постепенным началом болезни интоксикация наиболее выражена на 7–12-й день от начала заболевания. Характерными признаками интоксикации для микоплазменной и хламидийной пневмоний являются умеренная головная боль, миалгия, общая слабость.
Одним из постоянных признаков микоплазменной и хламидийной пневмоний, по нашим данным, является кашель, который возникает одновременно с лихорадкой. У больных микоплазменной пневмонией, в отличие от хламидийной, наблюдается частый, преимущественно непродуктивный, навязчивый, мучительный, приступообразный кашель (см. табл. 1). Наряду с кашлем, у пациентов с хламидийной и микоплазменной пневмониями наблюдаются умеренные признаки поражения верхних дыхательных путей — ринит, фарингит, ларингит. Ринит чаще всего встречается у больных хламидийной пневмонией (75,0 ± 10,8%, р 1:64), хламидийной инфекции — тест ИФА-метод и реакция МИФ, позволяющие идентифицировать специфические IgМ, IgG и IgА в диагностически значимых титрах (>1:16, >1:512 и >1:256 соответственно) и/или 4-кратное повышение титра IgG или IgА в парных сыворотках крови [1, 4, 7, 10]. По динамике уровня специфических антител, определяемых ИФА-методом (табл. 2), можно установить характер и стадию заболевания [10, 11, 13].
Также в последнее время для этиологической диагностики микоплазменной и хламидийной инфекции используется ПЦР, основанная на определении ДНК возбудителя с применением метода генных зондов [3, 4, 5, 7, 10]. С помощью ПЦР возможна быстрая диагностика микоплазменной и хламидийной инфекции, но этот метод не позволяет отличить активную инфекцию от персистирующей [1, 7, 10, 11].
Таким образом, для достоверной этиологической идентификации микоплазменной и хламидийной пневмоний необходимо проведение серологических тестов в комплексе с методами, основанными на выявлении ДНК микроорганизма.
Лечение микоплазменной и хламидийной пневмоний
Рассмотренные выше микробиологические особенности Mycoplasma pneumoniae и Chlamydophila pneumoniae (главным образом внутриклеточный цикл развития) объясняют неэффективность широко используемых в клинической практике β-лактамных антибиотиков (пенициллины и цефалоспорины) и обусловливают необходимость применения антимикробных препаратов, способных проникать и накапливаться в пораженных клетках, а также блокировать внутриклеточный синтез белка. Такими свойствами обладают макролиды, фторхинолоны и тетрациклины, которые и являются средствами эрадикационной терапии при Mycoplasma pneumoniae— и Chlamydophila pneumoniae-инфекции [3, 4, 7, 10, 11].
В России макролиды представлены широким спектром препаратов (см. табл. 3). Среди них наиболее активным в отношении Mycoplasma pneumoniae признан азитромицин, имеющий ряд преимуществ перед эритромицином и кларитромицином [4, 10, 11]. В отношении Chlamydophila pneumoniae наиболее активным средством признается кларитромицин [10]. Также эффективны в отношении этих внутриклеточных патогенов и некоторые другие представители макролидов: джозамицин, спирамицин. Старый антимикробный препарат из этой группы — эритромицин — также обладает антимикоплазменной и антихламидийной активностью, но, несомненно, уступает в этом отношении вышеперечисленным антибиотикам, обладая при этом целым рядом побочных эффектов [5, 10, 11].
Значительной активностью по отношению к Mycoplasma pneumoniae и Chlamydophila pneumoniae обладают фторхинолоны — офлоксацин (заноцин, таривид, офло), ципрофлоксацин (ципробай, ципролет, цифран, сифлокс, медоциприн, цифлоксинал), в связи с чем эти антимикробные препараты рассматриваются в качестве альтернативы макролидам при данной инфекции. Высокую активность проявляют новые фторхинолоны — левофлоксацин (таваник) и моксифлоксацин (авелокс). Моксифлоксацин и левофлоксацин успешно подавляют практически любую флору, вызывающую пневмонии.
При лечении микоплазменных и хламидийных пневмоний эффективны и тетрациклины, однако антибиотики этой группы не применяются при беременности, а также печеночной недостаточности. Вероятность проявления побочных эффектов при их применении может быть выше. Из тетрациклинов активны в отношении атипичных микроорганизмов доксициклин и моноциклин (см. табл. 3).
Продолжительность антимикробной терапии неосложненных бактериальных внебольничных пневмоний составляет 5–10 дней. Для лечения микоплазменной и хламидийной пневмоний рекомендуется применять антимикробные средства не менее 2–3 нед [4, 5, 10, 11]. Сокращение сроков лечения чревато развитием рецидива инфекции [4, 10].
При нетяжелом течении микоплазменной и хламидийной пневмоний антимикробные препараты назначаются внутрь в среднетерапевтических дозах. Естественно, при тяжелых пневмониях предпочтение следует отдавать внутривенному применению антибиотика. Эритромицин фосфат назначается до 1–2 г/сут в 2–3 введения (максимально по 1 г каждые 6 ч). Спирамицин используется внутривенно по 1,5 млн МЕ 3 раза в сутки, а кларитромицин — по 250 мг 2 раза в сутки с равными интервалами. Для разведения спирамицина и кларитромицина следует применять 5%-ный раствор глюкозы.
Стоимость внутривенного лечения антибиотиками (в частности, макролидами) весьма высока, поэтому используют ступенчатую терапию, при которой лечение начинается с внутривенного применения антибиотиков, а по достижении клинического эффекта (обычно через 2–3 дня) пациент переводится на пероральную терапию тем же препаратом или другим макролидом. Ступенчатая монотерапия макролидами может проводиться эритромицином, кларитромицином, спирамицином, т. е. препаратами, которые выпускаются в двух формах: для внутривенного введения и для приема внутрь.
Несмотря на большой спектр противомикробных препаратов, эффективное лечение микоплазменных и хламидийных пневмоний представляет до настоящего времени большую проблему [2, 6, 10, 11]. Это связано с тем, что их развитие, как правило, происходит на фоне снижения антиинфекционной резистентности организма, обусловленного угнетением иммунитета [8, 9, 10, 12]. Проведенное нами исследование показателей иммунограммы у пациентов с внебольничной пневмонией микоплазменной и хламидийной этиологии выявило снижение абсолютного числа лимфоцитов, зрелых Т-лимфоцитов (CD3+), Т-хелперов (CD4+), абсолютного числа Т-супрессоров (CD8+), угнетение функциональной активности Т-системы, проявляющееся снижением плотности рецепторов к IL-2 (CD25+), способности к бласттрансформации (CD71+ — лимфоциты) и апоптозу (CD95+), а также активацию гуморального иммунитета, что проявлялось повышением числа В-лимфоцитов (CD20+), уровня IgM и ЦИК.
Микоплазмы и хламидии на разных стадиях развития располагаются как внутриклеточно, так и внеклеточно, что требует для их элиминации участия гуморальных и клеточных механизмов иммунитета [8, 9, 10, 12]. Большинство антимикробных средств действует преимущественно на внеклеточную форму возбудителей. Это приводит к персистенции возбудителей, диссеминации ее в организме, хронизации процесса, формированию осложнений. Применение лишь антимикробных средств означает лишь временное подавление возбудителей, так как на фоне такой терапии происходит сохранение и даже усугубление иммунологических расстройств, что повышает риск рецидива заболеваний [14]. Так, по результатам наших исследований, к концу курса традиционной терапии происходило усугубление Т-клеточной депрессии: снижалось относительное и абсолютное количество Т-лимфоцитов (CD3+), Т-хелперов (CD4+), Т-супрессоров (CD8+) на фоне повышения уровня IgG, ЦИК, фагоцитарного индекса и уменьшения IgA.
В связи с этим хотелось бы подчеркнуть, что терапия микоплазменной и хламидийной пневмоний должна быть комплексной и включать, помимо антимикробных средств, препараты, действие которых направлено на коррекцию иммунного ответа.
С этой целью у больных микоплазменной и хламидийной пневмониями нами применяются иммуномодуляторы (ронколейкин, ликопид, тималин, тимоген).
Включение иммуномодуляторов в комплексное лечение микоплазменных и хламидийных пневмоний позволяет добиться ярко выраженного иммунологического эффекта. Последний сочетается с выраженным клиническим воздействием, проявляющимся сокращением сроков достижения клинико-лабораторной ремиссии в среднем на 3 койко-дня, уменьшением интоксикационных симптомов через 1–3 сут после начала лечения, сокращением лихорадочного периода в 2 раза, четкой положительной рентгенологической динамикой к 12-му дню лечения у 76,7% больных; значительным уменьшением вероятности развития повторных рецидивов и хронизации процесса.
Литература
Г. Г. Мусалимова, кандидат медицинских наук
В. Н. Саперов, доктор медицинских наук, профессор
Т. А. Никонорова
Чувашский ГМУ, г. Чебоксары